
����Ŀ����.����غ�Ũ����֮�������з�Ӧ��2KClO3+4HCl(Ũ)=2KCl+Cl2��+2ClO2��+2H2O.
��1���÷�Ӧ�з�����ԭ��Ӧ��������________������������________��
��2����˫���ű������ʽ�еĵ��ӵ�ʧ2KClO3+4HCl(Ũ)=2KCl+Cl2��+2ClO2��+2H2O________
��3������0.2 mol���ӷ���ת��ʱ�����ɵ����������Ϊ________L (��״��)����������HCl�����ʵ���Ϊ________mol.
��4�����ֱ��â�KMnO4(��ԭ������Mn2+)��MnO2(��ԭ������Mn2+) ��Ca(ClO)2(��ԭ������Cl2)����Ũ�����Ʊ���������Ũ���������������������������ʵ�����ͬʱ���������������ʵ������ٵ���________��
��.��֪��Ӧ��Cu+HNO3(ϡ)����Cu(NO3)2+NO��+H2O��
��1����ƽ������˫���ŷ�����ʾ������Ӧ�е���ת�Ƶķ������Ŀ��___Cu+___HNO3(ϡ) �� ___Cu(NO3)2+___NO��+___H2O��___________
��2���÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ_______��д���÷�Ӧ�����ӷ���ʽ______________________________________
���𰸡�KClO3 Cl2 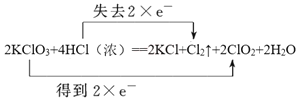 2.24 0.2 ��
2.24 0.2 �� 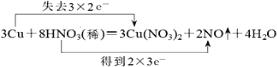 2:3 3Cu+8H++2NO3-=3Cu2+ +2NO��+4H2O
2:3 3Cu+8H++2NO3-=3Cu2+ +2NO��+4H2O
��������
��. ��1���÷�Ӧ��ClԪ�ػ��ϼ���+5�۱�Ϊ+4�ۡ�-1�۱�Ϊ0�ۣ��������������������Ũ�����ǻ�ԭ����������������ԭ��Ӧ����ԭ������������Ӧ����ԭ����Ӧ�IJ������������
��2���÷�Ӧ��ClԪ�ػ��ϼ���+5�۱�Ϊ+4�ۡ�-1�۱�Ϊ0�ۣ��������������������Ũ�����ǻ�ԭ������������1mol����ת�Ƶ��ӵ���ĿΪ2mol���ɴ���˫���ű������ת����Ŀ��
��3������ת�Ƶ��Ӻ���������֮��Ĺ�ϵʽ���㣻����ԭ���غ���㣻
��4����������������1mol�����ݵ��ӵ�ʧ�غ������𣬼��ɵó��𰸡�
��. �÷�Ӧ��CuԪ�ػ��ϼ���0�۱�Ϊ+2�ۡ�����NԪ�ػ��ϼ���+5�۱�Ϊ+2�ۣ����ʧ������С��������6������ͭ�ǻ�ԭ������������������������ԭ������������Ӧ��������������ԭ��Ӧ���Դ������
��.��1���÷�Ӧ��ClԪ�ػ��ϼ���+5�۱�Ϊ+4�ۡ�-1�۱�Ϊ0�ۣ��������������������Ũ�����ǻ�ԭ����������ԭ��Ӧ����KClO3������������Cl2���ʴ�Ϊ��KClO3��Cl2��
��2���÷�Ӧ��ClԪ�ػ��ϼ���+5�۱�Ϊ+4�ۡ�-1�۱�Ϊ0�ۣ��������������������Ũ�����ǻ�ԭ������������1mol����ת�Ƶ��ӵ���ĿΪ2mol����˫���ű������ת����ĿΪ��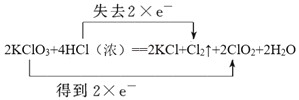 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��3���÷�Ӧ�������1mol�������ɣ�����2mol����ת�ƣ�������0.2mol����ת��ʱ�������������ʵ�����0.1mol�������=0.1mol��22.4L/mol=2.24L��
��������HCl�����ʵ���=0.1mol��2=0.2mol���ʴ�Ϊ��2.24��0.2��
��4����������������1mol����1molKMnO4ת��5mol�ĵ��ӣ��õ�����2.5mol��������1molMnO2ת��2mol�ĵ��ӣ�����1mol������������Ca(ClO)2+4HCl=2Cl2��+CaCl2+2H2O��֪��1mol Ca(ClO)2����2mol�����������������������������ٵ���1molMnO2����ѡ���ڡ�
��. �÷�Ӧ��CuԪ�ػ��ϼ���0�۱�Ϊ+2�ۡ�����NԪ�ػ��ϼ���+5�۱�Ϊ+2�ۣ����ʧ������С��������6��Ȼ���������غ���ƽ�������ʵ�ϵ������˫���ű���÷�Ӧ����ת�Ƶķ������ĿΪ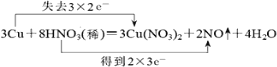 ��
��
�ʴ�Ϊ�� ��
��
��2���÷�Ӧ��CuԪ��ʧ���ӱ��������÷�Ӧ��ͭ�ǻ�ԭ����������������Cu(NO3)2��NԪ�صõ����ӣ���HNO3Ϊ���������ɵ����غ��֪�������뻹ԭ�������ʵ���֮����
2��3���������ӷ�Ӧ����ʽ��д����ѧ����д�����ӷ�Ӧ����ʽΪ��3Cu+8H++2NO3-=3Cu2+ +2NO��+4H2O�ʴ�Ϊ��2��3��3Cu+8H++2NO3-=3Cu2+ +2NO��+4H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������֪ʶ��գ�NA��������٤����������ֵ����
��1����״���� 11.2L NH3 �к�_______�������ӡ�
��2�����ʵ�����ȵ�SO2 �� SO3 ��������ԭ����Ŀ֮��Ϊ__________��
��3��4.8g CH4 ��������ԭ�ӵ����ʵ���Ϊ______________��
��4��12.4 g Na2R �� Na+0.4 mol���� Na2R ��Ħ������ΪΪ_________________��
��5������£�һ������ N2 �� 22.4L CO �����ķ�������ȣ��� N2 ������Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С���ռ���һ�ֺϽ��������̽��(��֪ͭԪ�ص���ɫ��Ӧ����ɫ)��
(1)��۰���ɫ����Ƥ�⻬��
(2)�ھƾ������������գ��������ɫ���Ͻ�Ƭ�ۻ����������䣻
(3)ȡ��ȥ��Ƥ�ĺϽ�10 g������������ϡ�����У��ռ�����״���µ�H2 8.96 L��
(4)��ȡ��ȥ��Ƥ�ĺϽ�10 g������������NaOH��Һ�У�Ҳ�ռ�����״���µ�H2 8.96 L��
�Ծݴ��жϣ��úϽ���һ�����е�Ԫ����________(дԪ�ط���)�����ܺ��е�Ԫ����________(��ѡ����)��
a��Ag b��Mg
c��Na d��Fe
����úϽ���ֻ��2��Ԫ�أ�����ߵ���������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾ���л�ѧ��Ӧ�����ӷ���ʽ����( )
A.����ͭ��Һ������������Һ��Ӧ��Ba2++![]() =BaSO4��
=BaSO4��
B.��NaHSO4��Һ����Ba(OH)2��Һ������Һ�����ԣ�2H++![]() +2OH-+Ba2+=BaSO4��+2H2O
+2OH-+Ba2+=BaSO4��+2H2O
C.����CO2ͨ�����ʯ��ˮ�У�2OH-+CO2=H2O+![]()
D.̼�������Һ����������������Һ��Ӧ��Ca2++![]() +OH-=CaCO3��+H2O
+OH-=CaCO3��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£��ɼ��顢��ȩ��HCHO����������ɵ�11.2���Ļ��������ȫȼ�պ�����0.7mol�Ķ�����̼���塣����������������������Ϊ( )
A. 20%B. 40%C. 60%D. 80%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯ�ͻ�����ƷΪԭ�Ϻϳɾ�����ܸ߷��Ӳ���R��ijҩ��ϳ�ԭ��E��һ�ֺϳ�·�����£����ַ�Ӧ�����Ͳ�����ȥ����
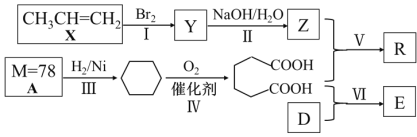
��֪D���Ҵ�����ͬϵ�E�ں˴Ź�����������3����ҷ������Ϊ2��2��3����ش��������⣺
��1��Y��������____��Z�Ĺ�����������____��A�ķ���ʽ��__________ ��
��2����Ӧ���ķ�Ӧ������_____��
��3��д��X�����Ӿ۷�Ӧ�Ļ�ѧ����ʽ________��
��4��д��II��Ӧ�Ļ�ѧ����ʽ_____________��
��5��д������Ӧ�Ļ�ѧ����ʽ___________��
��6��д����Z���Ҷ�����Ũ����������·�Ӧ���ɵ�һ����Ԫ��״������ļ���ʽ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��G�Ǻϳ�ij����ҩ����м��壬��ͼ�Ǻϳ� G�IJ������̣�
��֪��

�������Ľṹ��ʽΪ![]()
��ش��������⣺
(1)G �к��������ŵ�������_______��________��
(2)��Ӧ A��B �Ļ�ѧ����ʽΪ________________��
(3)�л��� F�Ľṹ��ʽΪ_________________��
(4)��Ӧ �ܡ��ݵķ�Ӧ���ͷֱ���_________��___________��
(5)д���������������� C ��ͬ���칹��Ľṹ��ʽ______________________��
������ֻ������ȡ����
������ֻ�� 4 �ֲ�ͬ��ѧ��������ԭ��
������NaHCO3��Һ��Ӧ���� CO2
(6)����������![]() Ϊԭ�ϣ��Ʊ�
Ϊԭ�ϣ��Ʊ�![]() �IJ�������ͼ���¡����������Ϣ����ѧ֪ʶ�����ϳ�·�߲������������Լ���ѡ����
�IJ�������ͼ���¡����������Ϣ����ѧ֪ʶ�����ϳ�·�߲������������Լ���ѡ����
![]() ______________
______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C�����ֳ���������Ԫ�صĵ��ʡ�������DΪ��ɫҺ�壬E��һ�ֳ������������塣��ת����ϵ��ͼ(��Ӧ�����Ͳ��ֲ�����ȥ)���Իش�

(1)E�ĵ���ʽ��__________��
(2)����X��B��D���ܷ�Ӧ���ɺ�ɫ����Y��Y�Ļ�ѧʽ��_________��
(3)����Z�����ڶԿ�������ɱ����������ˮ�����ʵȡ�Z��B�����Ԫ����ͬ��Z�����и�ԭ������������֮��Ϊ18��Z�����Ե⻯����Һ��Ӧ����B�͵ⵥ�ʣ���Ӧ�����ӷ���ʽ��__________________________��
(4)ȡ0.3 mol F������D��ֻ�Ϻ�������Һ����ͨ��0.2 mol E��ַ�Ӧ�����õ���ˮ��Һ�и������ӵ�Ũ���ɴ�С��˳����(������H+)_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������Ba(OH)2��Һ����μ���ϡ���ᣬֱ����������ͼ�е����߿ɽ��Ʊ�ʾ���������л����Һ�ĵ��������仯����(�õ���ǿ��I��ʾ)

A. ����AB. ����BC. ����CD. ����D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com