
【题目】在标准状况下,由甲烷、甲醛(HCHO)和乙烷组成的11.2升的混合气体完全燃烧后,生成0.7mol的二氧化碳气体。则混合气体中乙烷的体积分数为( )
A. 20%B. 40%C. 60%D. 80%
【答案】B
【解析】
11.2L甲烷、乙烷、HCHO(g)组成的混合气体的物质的量为11.2L÷22.4L/mol=0.5mol,生成的CO2的物质的量为0.7mol,故混合气体分子中平均C原子数目为0.7÷0.5=1.4,甲烷与甲醛的碳原子数目都是1,可以看做1个组分,可以将三种组分的混合物看做2种组分的混合物,令混合气体中乙烷的物质的量为xmol,甲烷与甲醛的总的物质的量为ymol,则:x+y=0.5,2x+y=0.7,联立可以解得:x=0.2,y=0.3,故乙烷的体积分数为![]() ×100%=40%。答案选B。
×100%=40%。答案选B。
【点晴】
题干中表面看是三种反应物,可以根据甲烷、甲醛分子中含有的碳原子相同(有时是氢原子个数相等或某元素的质量分数相等等),将二者看作一个整体,这样将3种组分变为2种,然后便可根据碳原子守恒列式计算出乙烷的物质的量。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是( )
A. SO3+ H2O= H2SO4 B. NH4Cl ![]() NH3
NH3![]() +HCl
+HCl![]()
C. Fe+CuSO4= FeSO4+Cu D. NaOH+HNO3=NaNO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.“抗坏血酸”维生素C具有还原性
B.杨万里《戏笔》中写道“野菊荒苔各铸钱,金黄铜绿两争妍”,铜绿的主要成分为碱式碳酸铜, Cu2(OH)2CO3属于碱式盐
C.向碳酸钠溶液中滴加稀盐酸,先不冒气泡,后冒气泡
D.食物腐败、钟乳石的形成、植物光合作用都与氧化还原反应有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物,由葡萄糖为原料合成E的过程如下:
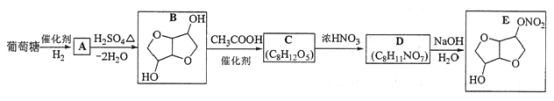
回答下列问题:
(1)葡萄糖的分子式为__________。
(2)A中含有的官能团的名称为__________。
(3)由B到C的反应类型为__________。
(4)C的结构简式为__________。
(5)由D到E的反应方程式为______________。
(6)F是B的同分异构体,7.30 g的F与足量饱和碳酸氢钠反应可释放出2.24 L二氧化碳(标准状况),F的可能结构共有________种(不考虑立体异构),其中核磁共振氢谱为三组峰,峰面积比为3∶1∶1的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019 年是“国际化学元素周期表年”。 1869 年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。下列说法中错误的是
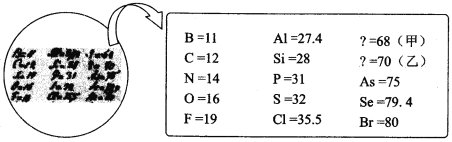
A. 甲位于现行元素周期表第四周期第ⅢA 族B. 原子半径比较:甲>乙> Si
C. 乙的简单气态氢化物的稳定性强于CH4D. 推测乙的单质可以用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.氯酸钾和浓盐酸之间有下列反应:2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O.
(1)该反应中发生还原反应的物质是________。氧化产物是________。
(2)用双线桥标出方程式中的电子得失2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O________
(3)当有0.2 mol电子发生转移时,生成的氯气的体积为________L (标准状况)。被氧化的HCl的物质的量为________mol.
(4)若分别用①KMnO4(还原产物是Mn2+)②MnO2(还原产物是Mn2+) ③Ca(ClO)2(还原产物是Cl2)氧化浓盐酸制备氯气,当浓盐酸足量且这三种氧化剂的物质的量相同时,生成氯气的物质的量最少的是________。
Ⅱ.已知反应:Cu+HNO3(稀)——Cu(NO3)2+NO↑+H2O;
(1)配平并用“双线桥法”表示上述反应中电子转移的方向和数目:___Cu+___HNO3(稀) = ___Cu(NO3)2+___NO↑+___H2O。___________
(2)该反应中氧化剂与还原剂的物质的量之比为_______;写出该反应的离子方程式______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题
Ⅰ.离子反应及离子方程式的书写在高中化学学习中占有重要的地位。电解质在水溶液中发生的反应一般是离子反应。
(1)现有下列几种物质:①盐酸 ②石墨 ③四氯化碳 ④SO2 ⑤熔融KHSO4 ⑥氨水 ⑦金属铜 ⑧NaHCO3晶体 ⑨氧化钙。这些物质中能导电的有_______;属于电解质的有_______________;属于非电解质的是_________(以上均填序号)。
(2)写出下列反应的离子方程式
①碳酸镁与稀硫酸反应_________________________________________________
②硫酸氢钠与氢氧化钠溶液反应_________________________________________
③向烧碱溶液中通入少量CO2气体:______________________________________
④向澄清石灰水中滴加足量的碳酸氢钠溶液:________________________________
⑤铝与氢氧化钠溶液反应:________________________________
⑥硫酸铝溶液与足量氨水反应:________________________________
Ⅱ.某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种。请填写下列空白:
(1)不做任何实验就可以肯定原溶液中不存在的离子是___________
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中,肯定存在的离子是_______,有关离子方程式为_________
(3)取(2)中的滤液,加入过量的NaOH,出现白色沉淀,说明原溶液中肯定有______________,有关的离子方程式为________________________________
(4)原溶液可能大量存在的阴离子是下列的__________
A.Cl- B.NO3- C.CO32- D.OH-
Ⅲ.实验室中,制取Fe(OH)3胶体的离子方程式是______________________________,
证明胶体已经制成的方法是_______________________________________________。
Ⅳ.检测人的血液中葡萄糖(简称血糖,分子式为C6H12O6,相对分子质量为180)含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1 L=l0dL)。以“mmol/L”表示时,人的血糖正常值在3.6~6.0 mmol/L之间。如果以“mg/dL”表示,血糖正常值范围是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3的混合物中,加入500 mL 1 mol/L的盐酸,恰好使混合物完全溶解,放出672 mL(标准状况)气体。向所得溶液中加入KSCN溶液无血红色出现,那么若用足量的CO在高温下还原相同质量的此混合物,能得到铁( )
A. 28 g B. 14 g
C. 12.32 g D. 条件不足,无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。
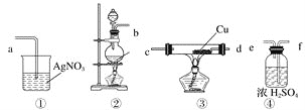
(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com