
【题目】请回答下列问题
Ⅰ.离子反应及离子方程式的书写在高中化学学习中占有重要的地位。电解质在水溶液中发生的反应一般是离子反应。
(1)现有下列几种物质:①盐酸 ②石墨 ③四氯化碳 ④SO2 ⑤熔融KHSO4 ⑥氨水 ⑦金属铜 ⑧NaHCO3晶体 ⑨氧化钙。这些物质中能导电的有_______;属于电解质的有_______________;属于非电解质的是_________(以上均填序号)。
(2)写出下列反应的离子方程式
①碳酸镁与稀硫酸反应_________________________________________________
②硫酸氢钠与氢氧化钠溶液反应_________________________________________
③向烧碱溶液中通入少量CO2气体:______________________________________
④向澄清石灰水中滴加足量的碳酸氢钠溶液:________________________________
⑤铝与氢氧化钠溶液反应:________________________________
⑥硫酸铝溶液与足量氨水反应:________________________________
Ⅱ.某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种。请填写下列空白:
(1)不做任何实验就可以肯定原溶液中不存在的离子是___________
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中,肯定存在的离子是_______,有关离子方程式为_________
(3)取(2)中的滤液,加入过量的NaOH,出现白色沉淀,说明原溶液中肯定有______________,有关的离子方程式为________________________________
(4)原溶液可能大量存在的阴离子是下列的__________
A.Cl- B.NO3- C.CO32- D.OH-
Ⅲ.实验室中,制取Fe(OH)3胶体的离子方程式是______________________________,
证明胶体已经制成的方法是_______________________________________________。
Ⅳ.检测人的血液中葡萄糖(简称血糖,分子式为C6H12O6,相对分子质量为180)含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1 L=l0dL)。以“mmol/L”表示时,人的血糖正常值在3.6~6.0 mmol/L之间。如果以“mg/dL”表示,血糖正常值范围是__________________
【答案】①②⑤⑥⑦; ⑤⑧⑨ ③④ MgCO3+2H+=Mg2++CO2↑+H2O H++OH-=H2O CO2+2OH-=CO32-+H2O Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O 2Al+2OH-+2H2O=2AlO2-+3H2↑ Al3++3NH3·H2O=Al(OH)3↓+3NH4+ Cu2+、Fe3+ Ag+ Ag++Cl=AgCl↓ Mg2+ Mg2++2OH=Mg(OH)2↓ B Fe3++3H2O![]() Fe(OH)3(胶体)+3H+ 丁达尔效应 64.8~108.0 mg/dL
Fe(OH)3(胶体)+3H+ 丁达尔效应 64.8~108.0 mg/dL
【解析】
Ⅰ.(1)电解质是指溶于水或熔融状态下导电的化合物,据此回答;
(2)离子反应方程式中只有可溶于水的强电解质可拆;
Ⅱ.(1)Cu2+、Fe3+均为有色离子;
(2)加入过量稀盐酸,有白色沉淀生成,再加入过量的稀硝酸,沉淀不消失,白色沉淀为AgCl;
(3)取②中的滤液,加入过量的NaOH,出现白色沉淀,白色沉淀为氢氧化镁;
(4)溶液中一定含银离子,与银离子结合生成沉淀的不能存在。
Ⅲ.胶体具有丁达尔效应;
Ⅳ. 以“mmol/L”表示时人的血糖正常值在3.6~6.0mmol/L之间,由1L=10dL,m=n×M来计算以“mg/dL”表示的血糖正常值范围
(1)①盐酸为混合物,是HCl的水溶液,可导电;②石墨为单质,可导电;③四氯化碳为非电解质,不可导电;④SO2为非电解质,不可导电;⑤熔融KHSO4为电解质可导电;⑥氨水为氨气的水溶液,混合物,可导电;⑦金属铜为单质,可导电;⑧NaHCO3晶体为电解质,但没有可自由移动的离子,不可导电;⑨氧化钙为电解质,不可导电;
故答案为:①②⑤⑥⑦;⑤⑧⑨;③④;
(2)①碳酸镁与稀硫酸反应生成硫酸镁、二氧化碳、和水,碳酸镁是沉淀不拆,故答案为:MgCO3+2H+=Mg2++CO2↑+H2O;
②硫酸氢钠与氢氧化钠溶液反应生成水和硫酸钠,硫酸钠为可溶于的强电解质可拆,故答案为: H++OH-=H2O;
③向烧碱溶液中通入少量CO2气体,烧碱即氢氧化钠,反应生成碳酸钠和水,故答案为:CO2+2OH-=CO32-+H2O;
④向澄清石灰水中滴加足量的碳酸氢钠溶液生成碳酸钙沉淀,因为碳酸氢钠足量,故溶液中没有氢氧根剩余,答案为:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O;
⑤铝与氢氧化钠溶液反应生成偏铝酸钠、氢气和水,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑
⑥硫酸铝溶液与足量氨水反应,一水合氨为弱碱,不能与氢氧化铝沉淀反应,故答案为:Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
Ⅱ、(1)不做任何实验就可以肯定原溶液中不存在的离子是Cu2+、Fe3+,
故答案为:Cu2+、Fe3+;
(2)加入过量稀盐酸,有白色沉淀生成,再加入过量的稀硝酸,沉淀不消失,白色沉淀为AgCl,说明原溶液中,肯定存在的离子是Ag+,反应的离子方程式:Ag++Cl-═AgCl↓;
故答案为:Ag+;Ag++Cl-═AgCl↓;
(3)取②中的滤液,加入过量的氢氧化钠,出现白色沉淀,白色沉淀为氢氧化镁,说明原溶液中,肯定存在的离子是Mg2+,反应的离子方程式:Mg2++2OH-═Mg(OH)2↓;
故答案为:Mg2+;Mg2++2OH-═Mg(OH)2↓;
(4)原溶液中存在Ag+,则Cl- 不能共存,原溶液中肯定有Mg2+,故CO32-、OH-不能与其共存,硝酸根离子不与所给的任何离子生成沉淀,故溶液中可能大量存在的离子是硝酸根,
故答案为:B。
Ⅲ.实验室中,制取Fe(OH)3胶体的离子方程式是Fe3++3H2O![]() Fe(OH)3(胶体)+3H+;通常用丁达尔效应来检验胶体,故答案为:Fe3++3H2O
Fe(OH)3(胶体)+3H+;通常用丁达尔效应来检验胶体,故答案为:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+;丁达尔效应;
Fe(OH)3(胶体)+3H+;丁达尔效应;
Ⅳ. 以“mmol/L”表示时人的血糖正常值在3.6~6.1mmol/L之间,则以“mg/dL”表示的血糖正常值范围为3.6×180/10~6.0×180/10,即为64.8~108.0 mg/dL,
故答案为:64.8~108.0 mg/dL.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】标准状况下,等体积的NH3和CH4两种气体,下列有关说法错误的是
A.所含分子数目相同B.所含氢原子物质的量之比为3∶4
C.质量之比为16∶17D.密度之比为17∶16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)顺铂(化学名称为顺二氯二氨合铂(II),化学式为PtCl2(NH3)2,相对分子质量为:300)是一种用于治疗癌症的药物,一片顺铂药片所含顺铂的质量为6×10-4g,那么一片顺铂药片中N原子的物质的量___mol;
(2)乙烯气体(C2H4)是石油化工产品之一,也是最重要的有机化工基础原料之一,在标准状况下其密度为___gL-1;
(3)现有一种矿泉水样品,1.0L的该矿泉水含有4.8×10-2gMg2+,则___L矿泉水中含有1mol Mg2+;
(4)某“84消毒液”1000mL,其有效成分为NaClO(式量:74.5),质量分数为14.9%,密度为1.2g/mL,其溶质的物质的量浓度为___molL﹣1;
(5)已知CO和CO2的混合气体7.2g,在标准状况下所占的体积为4.48L。则该混合气体中氧元素的质量为___g;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,由甲烷、甲醛(HCHO)和乙烷组成的11.2升的混合气体完全燃烧后,生成0.7mol的二氧化碳气体。则混合气体中乙烷的体积分数为( )
A. 20%B. 40%C. 60%D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回收利用硫和氮的氧化物是环境保护的重要举措。
(1)已知:2NO(g ) + O2(g)![]() 2NO2(g),正反应的活化能为c kJmolˉ1。该反应历程为:
2NO2(g),正反应的活化能为c kJmolˉ1。该反应历程为:
第一步:2NO(g ) ![]() N2O2(g) △H1 =-a kJmolˉ1 (快反应)
N2O2(g) △H1 =-a kJmolˉ1 (快反应)
第二步:N2O2(g ) + O2(g)![]() 2NO2(g) △H2 =-b kJmolˉ1 (慢反应)
2NO2(g) △H2 =-b kJmolˉ1 (慢反应)
①下列对上述反应过程表述正确的是__________(填标号)。
A.NO比N2O2稳定
B.该化学反应的速率主要由第二步决定
C.N2O2为该反应的中间产物
D.在一定条件下N2O2的浓度为0时反应达到平衡
②该反应逆反应的活化能为_______________。
(2)通过下列反应可从燃煤烟气中回收硫。2CO(g) + 2SO2(g)![]() 2CO2(g) + S(l) △H﹤0,在模拟回收硫的实验中,向某恒容密闭容器通入2.8 mol CO和1 molSO2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示:
2CO2(g) + S(l) △H﹤0,在模拟回收硫的实验中,向某恒容密闭容器通入2.8 mol CO和1 molSO2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示:
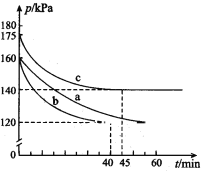
①与实验a相比,实验b改变的实验条件可能是______________________。
②实验b中的平衡转化率a(SO2)=_________。
(3)用NH3消除NO污染的反应原理为: 4NH3 + 6NO![]() 5N2 + 6H2O。不同温度条件下,NH3与NO的物质的量之比分别为 3:1、2:1、1:1 时,得到 NO 脱除率曲线如图所示:
5N2 + 6H2O。不同温度条件下,NH3与NO的物质的量之比分别为 3:1、2:1、1:1 时,得到 NO 脱除率曲线如图所示:

①曲线c对应NH3与NO 的物质的量之比是_______________。
②曲线a中 NO的起始浓度为4×10-4 mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____________ mg/(m3s)。
(4)双碱法除去SO2是指:用 NaOH 吸收SO2,并用CaO使 NaOH再生。NaOH溶液 ![]() Na2SO3溶液
Na2SO3溶液
①用化学方程式表示NaOH 再生的原理____________________________________ 。
②25℃ 时,将一定量的SO2通入到NaOH溶液中,两者完全反应,得到含Na2SO3、 NaHSO3的混合溶液,且溶液恰好呈中性,则该混合溶液中各离子浓度由大到小的顺序为_____________(已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是合成某新型药物的中间体,下图是合成 G的部分流程:
已知:

乙酸酐的结构简式为![]()
请回答下列问题:
(1)G 中含氧官能团的名称是_______、________。
(2)反应 A→B 的化学方程式为________________。
(3)有机物 F的结构简式为_________________。
(4)反应 ④、⑤的反应类型分别是_________、___________。
(5)写出满足下列条件的 C 的同分异构体的结构简式______________________。
Ⅰ.苯环上只有两种取代基
Ⅱ.分子中只有 4 种不同化学环境的氢原子
Ⅲ.能与NaHCO3溶液反应生成 CO2
(6)以乙酸酐和![]() 为原料,制备
为原料,制备![]() 的部分流程图如下。请结合相关信息和已学知识,将合成路线补充完整(无机试剂任选)。
的部分流程图如下。请结合相关信息和已学知识,将合成路线补充完整(无机试剂任选)。
![]() ______________
______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物![]() 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物![]() 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是
A. 溶液A和B均可以是盐酸或氢氧化钠溶液
B. 溶液A和B均可以选用稀硝酸
C. 若溶液B选用氯化铁溶液,则实验难以实现
D. 实验方案Ⅱ更便于实施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如下图:

请回答下列问题:
(1)配制溶液时,一般可以分为以下几个主要步骤:
①量取 ②计算 ③溶解 ④定容 ⑤转移 ⑥洗涤 ⑦装瓶,其正确的操作顺序为___________(填序号)。
(2)实验室只有100mL、250mL、500mL三种规格的容量瓶,但要配制480 mL 0.50 mol/L的稀硫酸,需取该浓硫酸______mL。
(3)接下来完成此实验你将用到的仪器有20mL量筒、烧杯、玻璃棒、____________。
(4)要从所配溶液中取出50 mL盛装于试剂瓶中,给它贴上标签,则标签的内容是________________;若再从中取出10 mL溶液稀释至20 mL,则稀释后溶液的物质的量浓度为__________。
(5)下列操作会使所配溶液浓度偏低的是__________。
A. 用量筒量取浓硫酸,读数时仰视刻度线 B. 转移溶液时未洗涤烧杯
C. 容量瓶用蒸馏水洗净后仍残留有蒸馏水 D. 定容时俯视容量瓶的刻度线
E. 定容摇匀后,发现液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一处于平衡状态的可逆反应:X(s)+3Y(g)![]() 2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
A.①③⑤B.②③⑤C.②③⑥D.②④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com