
【题目】CO2是目前大气中含量最高的一种温室气体,CO2的综合利用是解决温室问题的有效途径。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。已知部分反应的热化学方程式如下:
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(1)△H1=-726.5kJmol-1
O2(g)=CO2(g)+2H2O(1)△H1=-726.5kJmol-1
H2(g)+![]() O2(g)=H2O(1)△H2=-285.8kJmol-1
O2(g)=H2O(1)△H2=-285.8kJmol-1
H2O(g)=H2O(l) △H3=-44kJmol-1
则CO2与H2反应生成气态CH3OH和水蒸气的热化学方程式为__。
(2)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)![]() 2CO(g) △H,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。回答下列问题:
2CO(g) △H,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。回答下列问题:
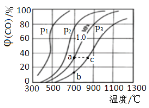
①压强p1__1.0MPa(填>、=或<)。
②900℃、1.0MPa时,足量碳与amolCO2反应达平衡后,CO2的转化率为__,该反应的平衡常数Kp=__(保留小数点后一位数字)(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)①以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)![]() CH3COOH(g)。为了提高该反应中CO2的转化率,可以采取的措施是___(写一条即可)。
CH3COOH(g)。为了提高该反应中CO2的转化率,可以采取的措施是___(写一条即可)。
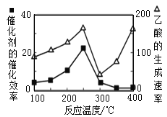
②在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,乙酸的生成速率降低的主要原因是__;300~400℃时,乙酸的生成速率升高的主要原因是__。
(4)将1.0×10-3mol/LCoSO4与1.2×10-3mol/L的Na2CO3等体积混合,此时溶液中的Co2+的浓度为___mol/L。(已知:CoCO3的溶度积为:Ksp=1.0×10-13)
【答案】CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-86.9kJmol-1 < 66.7% 3.2MPa 增大反应体系压强或增大CH4的浓度或将乙酸液化分离出来 催化剂的催化效率降低 温度升高,化学反应速率加快 1.0×10-9
CH3OH(g)+H2O(g) △H=-86.9kJmol-1 < 66.7% 3.2MPa 增大反应体系压强或增大CH4的浓度或将乙酸液化分离出来 催化剂的催化效率降低 温度升高,化学反应速率加快 1.0×10-9
【解析】
(1)根根据盖斯定律进行计算;
(2)同温下,可逆反应正方向为气体体积增大的反应,根据勒夏特列原理,压强小的一氧化碳体积分数大;
(3)根据有效碰撞理论和勒夏特列原理进行回答;
(4)根据溶度积公式进行计算。
(1)CO2与H2反应生成气态CH3OH和水蒸气的热化学方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H= -△H1+3△H2-△H3=-86.9kJmol-1。
CH3OH(g)+H2O(g) △H= -△H1+3△H2-△H3=-86.9kJmol-1。
(2)①同温下,p1压强下的一氧化碳体积分数大,可逆反应正方向为气体体积增大的反应,根据勒夏特列原理,压强p1<1.0MPa。
②由图可知,900℃、1.0MPa时,足量碳与amolCO2反应达平衡后,一氧化碳的体积分数为80%,设反应消耗了二氧化碳的物质的量为xmol,列三段式:
C(s)+CO2(g)![]() 2CO(g)
2CO(g)
反应前 amol 0
变化量 xmol 2xmol
反应后 (a-x)mol 2xmol
同温同压下,体积之比与物质的量之比相等,一氧化碳的体积分数=![]() ,即x=
,即x=![]() mol,CO2的转化率为
mol,CO2的转化率为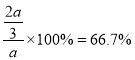 ,该反应的平衡常数Kp=
,该反应的平衡常数Kp=![]() ;
;
(3)①可逆反应为CO2(g)+CH4(g)![]() CH3COOH(g),根据有效碰撞原理,为了提高该反应中CO2的转化率,可以采取的措施是增大反应体系压强或增大CH4的浓度或将乙酸液化分离出来。
CH3COOH(g),根据有效碰撞原理,为了提高该反应中CO2的转化率,可以采取的措施是增大反应体系压强或增大CH4的浓度或将乙酸液化分离出来。
②在不同温度下催化剂的催化效率与乙酸的生成速率如图,250~300℃时,乙酸的生成速率降低的主要原因是催化剂的催化效率降低;300~400℃时,乙酸的生成速率升高的主要原因是温度升高,化学反应速率加快。
(4)CoCO3的溶度积Ksp=1.0×10-13=![]() ,将1.0×10-3mol/LCoSO4与1.2×10-3mol/L的Na2CO3等体积混合,碳酸根过量,此时碳酸根的浓度为
,将1.0×10-3mol/LCoSO4与1.2×10-3mol/L的Na2CO3等体积混合,碳酸根过量,此时碳酸根的浓度为![]() ,即此时溶液中的Co2+的浓度为
,即此时溶液中的Co2+的浓度为![]() 。
。


科目:高中化学 来源: 题型:
【题目】25℃时,用0.1 mol·L-1 NaOH溶液滴定某二元弱酸H2A,H2A被滴定分数、pH及物种分布分数δ[δ(X)=![]() ]如图所示:
]如图所示:
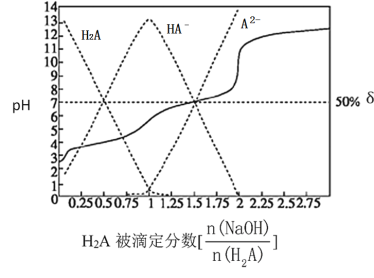
下列说法错误的是
A.用NaOH溶液滴定0.1 mol·L-1 NaHA溶液可用酚酞作指示剂
B.0.1 mol·L-1 NaHA溶液中:c(Na+)>c(HA-)>c(A2-)>c(H2A)
C.0.1 mol·L-1 Na2A溶液中:c(Na+)<c(HA-)+2c(A2-)
D.H2A的K2=1×10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法中正确的是( )
A.0.1mol/L Na2SO4溶于水中,所得溶液中Na+个数为0.2NA
B.78g Na2O2中含有离子总数为3NA
C.标准状况下,NA个水分子所占的体积为22.4L
D.Na2O2与CO2反应生成2.24L氧气转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据所给的10种元素,完成以下各小题。
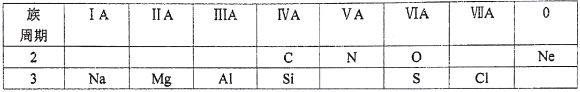
(1)镁的原子结构示意图为____。
(2)H2SO4与HClO4中,酸性较强的是____。
(3)NaOH与Al (OH)3中,属于两性氢氧化物的是____。它常用作治疗胃酸(含盐酸)过多的药物,该反应的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废气中的 H2S 通过高温热分解可制取氢气:2H2S(g) ![]() 2H2(g)+S2(g)。现在 3L 密闭容器中,控制不同 温度进行 H2S 分解实验。
2H2(g)+S2(g)。现在 3L 密闭容器中,控制不同 温度进行 H2S 分解实验。
(1)某温度时,测得反应体系中有气体 1.31mol,反应 tmin 后,测得气体为 1.37mol,则 tmin 内 H2 的生成 速率为___________________。
(2) 某温度时,可作为判断反应达到平衡的标志依据是_____(选填编号)。
a. 气体的压强不发生变化 b. 气体的密度不发生变化
(3)实验结果如图。图中曲线 a 表示 H2S 的平衡转化率与温度关系,曲线b 表示不同温度下、反应经过相同时间且未达到化学平衡时 H2S 的转化率。

该反应为________反应(填“放热”或“吸热”)。在容器体积不变的情况下, 如果要提高 H2的体积分数,可采取的一种措施是_______________________
(4)使 1LH2S 与 20L 空气(空气中 O2 体积分数为 0.2)完全反应后恢复到室温,混合气体的体积是________L。若 2gH2S 完全燃烧后生成二氧化硫和水蒸气,同时放出 29.4kJ 的热量,该反应的热化学方程式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中进行如下反应:N2+3H2![]() 2NH3,5min内氨的物质的量增加了0.1mol,则反应速率为
2NH3,5min内氨的物质的量增加了0.1mol,则反应速率为
A.v(H2)=0.02 mol/(L·min)
B.v(N2)=0.01 mol/(L·min)
C.v(NH3)=0.01 mol/(L·min)
D.v(N2)=0.03 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法中错误的是
A.正丁烷和异丁烷互为同分异构体,但其沸点不同
B.将等物质的量的乙烯、乙醇完全燃烧,它们的耗氧量不同
C.键线式为![]() 、
、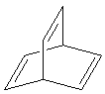 的烃的一氯代物均有两种
的烃的一氯代物均有两种
D.苯乙烯、乙苯使酸性高锰酸钾溶液褪色均发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的镁分别在足量的二氧化碳、氧气中燃烧,有关叙述正确的是( )
A.在二氧化碳中燃烧产生的固体质量大
B.在氧气中产生的氧化镁质量大
C.氧化剂与还原剂物质的量之比都是2∶1
D.反应中都是氧元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是__________。
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________、________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是_______________。
②E处干燥管中盛放的药品是碱石灰,其作用是_____________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量_____________(填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com