
【题目】设NA为阿伏加德罗常数,下列说法中正确的是( )
A.0.1mol/L Na2SO4溶于水中,所得溶液中Na+个数为0.2NA
B.78g Na2O2中含有离子总数为3NA
C.标准状况下,NA个水分子所占的体积为22.4L
D.Na2O2与CO2反应生成2.24L氧气转移电子数为0.2NA
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种短周期主族元素的原子序数依次增大。X、Y原子的最外层电子数之比为2∶3,Z+与Y2-核外电子排布完全相同,常温下,W的一种单质为淡黄色固体。下列说法不正确的是( )
A. 离子半径:W>Z>Y
B. 简单气态氢化物的热稳定性:Y>W
C. Y分别与X、Z、W能形成两种或两种以上的化合物
D. Z与Y、W分别形成的化合物溶于水,溶液均呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)3[Fe(SCN)6]、[Fe(TCNE)(NCCH3)2][FeCl4] 、K4[Fe(CN)6]·3H2O等铁的配合物用途非常广泛。回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______。
(2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是____。
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是_____ 。
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE( )。
)。
①CH3CN中碳原子的杂化方式是 ____ 和_____ 。
②TCNE中第一电离能较大的是 ___(填元素符号),分子中所有原子____(填“在”或“不在”)同一平面,分子中σ 键与π键的数目之比是 ___。
(5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成, Fe3C 的晶胞结构如图所示:

Fe3C的密度为 ___(列出计算式)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如下反应(未配平):BrF3+H2O→Br2+O2+HBrO3+HF,反应后测得生成Br2与O2各1 mol。下列判断错误的是
A.反应共转移6 mol电子
B.氧化剂为BrF3,还原产物为Br2
C.配平后H2O与HF的物质的量之比为5∶9
D.被水还原的BrF3与被自身还原的BrF3的物质的量之比是1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将H2S转化为可再利用的资源是能源研究领域的重要课题。
(1)H2S的转化
Ⅰ | 克劳斯法 |
|
Ⅱ | 铁盐氧化法 |
|
Ⅲ | 光分解法 |
|
① 反应Ⅰ的化学方程式是________。
② 反应Ⅱ:____+ 1 H2S ==____Fe2+ + ____S↓ + ____(将反应补充完整)。
③ 反应Ⅲ体现了H2S的稳定性弱于H2O。结合原子结构解释二者稳定性差异的原因:_______。
(2)反应Ⅲ硫的产率低,反应Ⅱ的原子利用率低。我国科研人员设想将两个反应耦合,实现由H2S高效产生S和H2,电子转移过程如图。
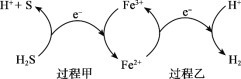
过程甲、乙中,氧化剂分别是______。
(3)按照设计,科研人员研究如下。
① 首先研究过程乙是否可行,装置如图。经检验,n极区产生了Fe3+,p极产生了H2。n极区产生Fe3+的可能原因:
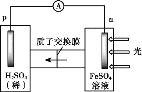
ⅰ.Fe2+ - e- = Fe3+
ⅱ.2H2O -4e-=O2 +4H+,_______(写离子方程式)。经确认,ⅰ是产生Fe3+的原因。过程乙可行。
② 光照产生Fe3+后,向n极区注入H2S溶液,有S生成,持续产生电流,p极产生H2。研究S产生的原因,设计如下实验方案:______。 经确认,S是由Fe3+氧化H2S所得,H2S不能直接放电。过程甲可行。
(4)综上,反应Ⅱ、Ⅲ能耦合,同时能高效产生H2和S,其工作原理如图。
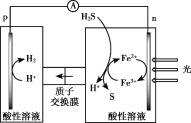
进一步研究发现,除了Fe3+/Fe2+ 外,I3-/I- 也能实现如图所示循环过程。结合化学用语,说明I3-/I- 能够使S源源不断产生的原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用 NaOH 标准溶液滴定未知浓度的盐酸,进行了如下实验:
取 15.00mL 待测溶液于 250mL 锥形瓶中,加入 1~2 滴酚酞试液,用 NaOH 标准溶液滴定。按上述操作方 法再重复 2 次。
(1)填空:(①、②小题中选填“偏高”、“偏低”或“无影响”)
①装碱滴定管用蒸馏水洗涤后,直接加入 NaOH 标准溶液进行滴定,则待测液的浓度_____;
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去 NaOH 标准溶液的体积_____;
③滴定时边滴边摇动锥形瓶,眼睛应观察_____;
④滴定达到终点时,酚酞指示剂由_____色变成_____色。
(2)滴定结果如下表所示:

若 NaOH 标准溶液的浓度为 0.1010mol/L,则待测液的浓度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在体积均为20mL、浓度均为0.1mol·L-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)表示为pH水=-lgc(H+)水。pH水与滴加氢氧化钠溶液体积的关系如图所示。
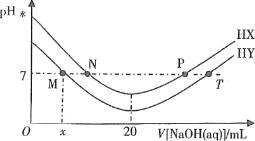
下列推断正确的是
A.HX的电离方程式为HX=H++X-
B.T点时c(Na+)=c(Y-)>c(H+)=c(OH-)
C.常温下用蒸馏水分别稀释N、P点溶液,pH都降低
D.常温下,HY的电离常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是目前大气中含量最高的一种温室气体,CO2的综合利用是解决温室问题的有效途径。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。已知部分反应的热化学方程式如下:
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(1)△H1=-726.5kJmol-1
O2(g)=CO2(g)+2H2O(1)△H1=-726.5kJmol-1
H2(g)+![]() O2(g)=H2O(1)△H2=-285.8kJmol-1
O2(g)=H2O(1)△H2=-285.8kJmol-1
H2O(g)=H2O(l) △H3=-44kJmol-1
则CO2与H2反应生成气态CH3OH和水蒸气的热化学方程式为__。
(2)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)![]() 2CO(g) △H,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。回答下列问题:
2CO(g) △H,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。回答下列问题:
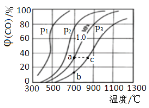
①压强p1__1.0MPa(填>、=或<)。
②900℃、1.0MPa时,足量碳与amolCO2反应达平衡后,CO2的转化率为__,该反应的平衡常数Kp=__(保留小数点后一位数字)(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)①以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)![]() CH3COOH(g)。为了提高该反应中CO2的转化率,可以采取的措施是___(写一条即可)。
CH3COOH(g)。为了提高该反应中CO2的转化率,可以采取的措施是___(写一条即可)。
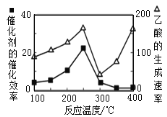
②在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,乙酸的生成速率降低的主要原因是__;300~400℃时,乙酸的生成速率升高的主要原因是__。
(4)将1.0×10-3mol/LCoSO4与1.2×10-3mol/L的Na2CO3等体积混合,此时溶液中的Co2+的浓度为___mol/L。(已知:CoCO3的溶度积为:Ksp=1.0×10-13)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质由铁和氧两种元素组成,实验测得铁元素与氧元素的质量比为21∶8,关于该物质的下列说法中不正确的是( )
A.铁元素与氧元素物质的量比为3∶4
B.该物质可能为四氧化三铁
C.该物质一定为四氧化三铁
D.该物质可能为混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com