
【题目】某物质由铁和氧两种元素组成,实验测得铁元素与氧元素的质量比为21∶8,关于该物质的下列说法中不正确的是( )
A.铁元素与氧元素物质的量比为3∶4
B.该物质可能为四氧化三铁
C.该物质一定为四氧化三铁
D.该物质可能为混合物
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法中正确的是( )
A.0.1mol/L Na2SO4溶于水中,所得溶液中Na+个数为0.2NA
B.78g Na2O2中含有离子总数为3NA
C.标准状况下,NA个水分子所占的体积为22.4L
D.Na2O2与CO2反应生成2.24L氧气转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法中错误的是
A.正丁烷和异丁烷互为同分异构体,但其沸点不同
B.将等物质的量的乙烯、乙醇完全燃烧,它们的耗氧量不同
C.键线式为![]() 、
、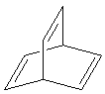 的烃的一氯代物均有两种
的烃的一氯代物均有两种
D.苯乙烯、乙苯使酸性高锰酸钾溶液褪色均发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的镁分别在足量的二氧化碳、氧气中燃烧,有关叙述正确的是( )
A.在二氧化碳中燃烧产生的固体质量大
B.在氧气中产生的氧化镁质量大
C.氧化剂与还原剂物质的量之比都是2∶1
D.反应中都是氧元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)生产中曾用铝热反应焊接钢轨,铝与氧化铁反应的化学方程式为___________。
(2)复方氢氧化铝治疗胃酸过多时,氢氧化铝表现______性;氢氧化铝的电离方程式_______________。
(3)铁、铝、铁铝合金三种物质中硬度最大的是_________________。
(4)铝锭能做成铝壶烧水,表现铝的导热性和______________,表面破损的铝制品,放久了破损处会有一层“白毛”产生,“白毛”既能溶于酸又能溶于碱溶液,写出形成“白毛”的化学方程式________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学通过对比实验了解Na2CO3和NaHCO3性质的异同,下表是他们撰写的实验报告的一部分。
① | 在贴有标签a、b的试管中分别加入1.0g Na2CO3固体和NaHCO3固体,观察外观。 | / |
② | 继续向两试管中分别加入10.0mL水,用力振荡,观察现象。 | / |
③ | 再分别向两试管中滴加2滴酚酞溶液,观察现象。 | 溶液均变红,颜色较深的试管是 (填 “a”或“b”)。 |
④ | 最后分别向两溶液中滴加足量盐酸。 | 红色褪去,均有无色气体产生.经计算生成气体的是a b(填“>”“<”或“=”)。 |
⑤ | 加热大试管一段时间。(注:棉花球沾有无水硫酸铜粉末)
| / |
(1)请帮助该小组同学完成实验报告中放入内容_____________。
(2)已知:20℃时Na2CO3的溶解度为20.5g。由实验_______(填实验序号)现象可知,20℃时NaHCO3的溶解度小于20.5g;如果向饱和Na2CO3溶液中不断通入CO2气体,现象是________,化学方程式是_________。
(3)由实验⑤可以得出结论是_______,用化学方程式说明得出结论的原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含锂电解铝废渣(主要成分为LiF、AlF3、NaF,少量CaO等)为原料,生产高纯度LiOH的工艺流程如图:(已知:常温下,LiOH可溶于水,Li2CO3微溶于水)
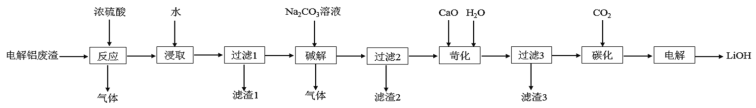
(1)含锂电解铝废渣与浓硫酸在200~400℃条件下反应2h。“滤渣1”主要成分是___(填化学式)。
(2)“过滤2”需要趁热在恒温装置中进行,否则会导致Li2SO4的收率下降,原因是___。
(已知部分物质的溶解度数据见下表)
温度/℃ | Li2SO4/g | Al2(SO4)3/g | Na2SO4/g |
0 | 36.1 | 31.2 | 4.9 |
10 | 35.4 | 33.5 | 9.1 |
20 | 34.8 | 36.5 | 19.5 |
30 | 34.3 | 40.4 | 40.8 |
40 | 33.9 | 45.7 | 48.8 |
(3)40°C下进行“碱解”,得到粗碳酸锂与氢氧化铝的混合滤渣,生成氢氧化铝的离子方程式为___;若碱解前滤液中c(Li+)=4molL-1,加入等体积的Na2CO3溶液后,Li+的沉降率到99%,则“滤液2”中c(CO32-)=___molL-1。[Ksp(Li2CO3)=1.6×10-3]
(4)“苛化”过程,若氧化钙过量,则可能会造成___。
(5)整个工艺流程中可以循环利用的物质有___。
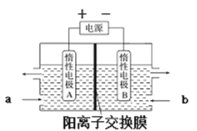
(6)“电解”原理如图所示。“碳化”后的电解液应从(填“a”或“b”)___口注入。阴极的电极反应式为___。
(7)高纯度LiOH可转化为电池级Li2CO3。将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是__________。
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________、________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是_______________。
②E处干燥管中盛放的药品是碱石灰,其作用是_____________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量_____________(填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某无色溶液中只含有下列7种离子中的某几种:Mg2+、H+、Ag+、Na+、Cl-、HCO3-、OH-,已知该溶液与铝反应放出氢气,若反应后生成AlO2-,则溶液中一定存在的离子有______________,一定不存在的离子有______________,可能存在的离子有__________________,该溶液与铝反应放出氢气的离子方程式为_____________________________________。
(2)铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,某兴趣小组首先将其制成水溶液。
①通常将氢氧化钠溶液加入氯化亚铁溶液的实验现象是___,
②书写氢氧化亚铁在空气中转化为氢氧化铁的化学方程式___。
(3)在所得的FeCl3、CuCl2混合溶液中加入镁粉,产生的气体是___。试解释原因:___。有同学提出加入CuO以除去Fe3+。你认为理由是___。
(4)能不能直接蒸发CuCl2溶液得到CuCl2·2H2O晶体?___(填“能”或“不能”)。若能,不用回答;若不能,说明理由___。
(5)将FeCl3固体溶于蒸馏水配制溶液时常会出现浑浊,得不到澄清的氯化铁溶液,其原因是___,如果要得到澄清的氯化铁溶液,可采取的措施是___。
(6)泡沫灭火器使用NaHCO3和Al(SO4)3溶液反应产生CO2来灭火。试从平衡移动的角度分析以上两种溶液反应产生CO2的原因:____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com