
【题目】以含锂电解铝废渣(主要成分为LiF、AlF3、NaF,少量CaO等)为原料,生产高纯度LiOH的工艺流程如图:(已知:常温下,LiOH可溶于水,Li2CO3微溶于水)
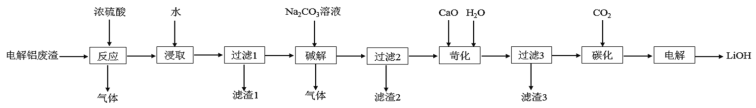
(1)含锂电解铝废渣与浓硫酸在200~400℃条件下反应2h。“滤渣1”主要成分是___(填化学式)。
(2)“过滤2”需要趁热在恒温装置中进行,否则会导致Li2SO4的收率下降,原因是___。
(已知部分物质的溶解度数据见下表)
温度/℃ | Li2SO4/g | Al2(SO4)3/g | Na2SO4/g |
0 | 36.1 | 31.2 | 4.9 |
10 | 35.4 | 33.5 | 9.1 |
20 | 34.8 | 36.5 | 19.5 |
30 | 34.3 | 40.4 | 40.8 |
40 | 33.9 | 45.7 | 48.8 |
(3)40°C下进行“碱解”,得到粗碳酸锂与氢氧化铝的混合滤渣,生成氢氧化铝的离子方程式为___;若碱解前滤液中c(Li+)=4molL-1,加入等体积的Na2CO3溶液后,Li+的沉降率到99%,则“滤液2”中c(CO32-)=___molL-1。[Ksp(Li2CO3)=1.6×10-3]
(4)“苛化”过程,若氧化钙过量,则可能会造成___。
(5)整个工艺流程中可以循环利用的物质有___。
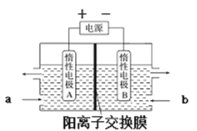
(6)“电解”原理如图所示。“碳化”后的电解液应从(填“a”或“b”)___口注入。阴极的电极反应式为___。
(7)高纯度LiOH可转化为电池级Li2CO3。将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式为___。
【答案】CaSO4 溶液温度下降,硫酸钠结晶析出时,夹裹了部分的硫酸锂共沉淀 2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ 4 碳酸锂产品的钙离子含量相对升高(或使得氢氧化铝溶解进入溶液,导致最终产品的纯度下降) CO2 a 2H2O+2e-=H2↑+2OH- Li2CO3+2C+2FeSO4![]() 2LiFePO4+3CO↑
2LiFePO4+3CO↑
【解析】
含锂电解铝废渣(主要成分为LiF、AIF3、NaF,少量CaO等)与浓硫酸反应生成Li2SO4、Al2(SO4)3、Na2SO4和CaSO4。CaSO4是微溶物,加水溶解,滤渣1为CaSO4,向滤液中加入Na2CO3溶液,碱解生成CO2气体、Al(OH)3和Na2SO4及Li2CO3,趁热过滤,向滤液中加入氧化钙生成CaSO4、Al(OH)3、LiOH,过滤,向滤液中加入CO2得到Li2CO3,电解得到LiOH。
(1)根据分析得到“滤渣1”主要成分是CaSO4;
(2)“过滤2”需要趁热在恒温装置中进行,根据表中溶解度曲线得出硫酸钠晶体析出可能会夹带着硫酸锂,从而导致Li2SO4的收率下降;故答案为:溶液温度下降,硫酸钠结晶析出时,夹裹了部分的硫酸锂共沉淀;
(3)40°C下进行“碱解”,得到粗碳酸锂与氢氧化铝的混合滤渣,生成氢氧化铝主要是碳酸根和铝离子发生双水解,其离子方程式为2Al3++3CO32+3H2O=2Al(OH)3↓+3CO2↑;若碱解前滤液中c(Li+)=4molL1,加入等体积的Na2CO3溶液后,Li+的沉降率到99%,则此时溶液中c(Li+)=![]() ,根据
,根据![]() ,得到“滤液2”中
,得到“滤液2”中![]() ;
;
(4)“苛化”过程,若氧化钙过量,溶液中含有多余的钙离子,也可能将生成的氢氧化铝溶解进入得到溶解中;故答案为:碳酸锂产品的钙离子含量相对升高(或使得氢氧化铝溶解进入溶液,导致最终产品的纯度下降)。
(5)碱解的过程中生成CO2,在碳化过程中加入CO2,因此整个工艺流程中可以循环利用的物质有CO2;
(6)“电解”原理如图所示,LiOH是从右边得到,而锂离子通过阳离子交换膜进入到右室,因此“碳化”后的电解液应从a口注入。阴极是水中的氢离子得到电子,其电极反应式为2H2O+2e-=H2↑+2OH-;
(7)将电池级Li2CO3和C、FePO4高温下反应,根据氧化还原反应,FePO4中Fe化合价降低,则C化合价升高,生成LiFePO4和一种可燃性气体即CO,该反应的化学方程式为Li2CO3+2C+2FeSO4![]() 2LiFePO4+3CO↑。
2LiFePO4+3CO↑。


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】常温下,在体积均为20mL、浓度均为0.1mol·L-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)表示为pH水=-lgc(H+)水。pH水与滴加氢氧化钠溶液体积的关系如图所示。
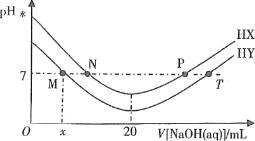
下列推断正确的是
A.HX的电离方程式为HX=H++X-
B.T点时c(Na+)=c(Y-)>c(H+)=c(OH-)
C.常温下用蒸馏水分别稀释N、P点溶液,pH都降低
D.常温下,HY的电离常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO、SiO2等)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红等产品的流程如下图所示:
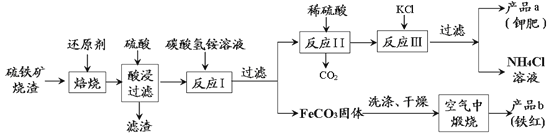
(1)硫铁矿烧渣焙烧时所添加的还原剂最有可能的是______。
A.铝 B.锌 C.碳
(2)酸浸、过滤后滤液中的主要成分是________。滤渣是__________。
(3)反应Ⅰ的溶液为防止被氧化,需加___________,其离子方程式为__________________。
(4)反应Ⅰ的反应温度一般需控制在15℃以下,其目的是____________________。
(5)空气中煅烧FeCO3生成产品b的化学反应方程式为_____________________。
(6)检验产品a中是否含有氯化物杂质的实验操作是:取少量产品a于试管中配成溶液,___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质由铁和氧两种元素组成,实验测得铁元素与氧元素的质量比为21∶8,关于该物质的下列说法中不正确的是( )
A.铁元素与氧元素物质的量比为3∶4
B.该物质可能为四氧化三铁
C.该物质一定为四氧化三铁
D.该物质可能为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
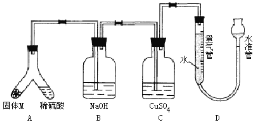
【题目】如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:

(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂和C中相同,E中试剂所起的作用__,B装置除可检出某产物外,还可起到__作用。
(2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)
由上述实验事实可知:
(1)①固体M中一定有的物质是____________(填化学式) 理由是_________
②其中一种物质的质量可以确定为___________g(用代数式表示)。
(2)B装置的名称是________,B装置的作用_____________。
(3)C装置的作用是______,如果实验中没有B装置,则C装置中产生的现象是_______。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是____________。
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是_____________
A.M中有未反应的铁和硫 B.测定气体体积时水准管的水面高于量气管的水面
C.A中留有反应生成的气体 D.气体进入D装置前未用浓硫酸干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.72g金属钠、氧化钠和过氧化钠的混合物与足量水反应,在标准状况下得到672mL混合气体,将混合气体电火花点燃,恰好完全反应,则原混合物中钠、氧化钠、过氧化钠的物质的量之比为( )
A. 3:2:1 B. 4:2:1 C. 2:1:1 D. 1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是

A. 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B. 图中b、c两点对应的NaHSO3反应速率相等
C. 图中a点对应的NaHSO3反应速率为5.0 ×10-5mol·L-1·s-1
D. 温度高于40℃时,淀粉不宜用作该实验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】DBFC燃料电池的结构如图,该电池的总反应为NaBH4+4H2O2=NaBO2+6H2O。下列关于电池工作时的相关分析不正确的是( )
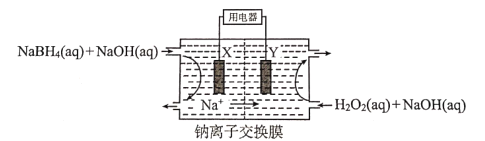
A.X极为正极,电流经X流向外电路
B.Y极发生的还原反应为H2O2+2e-=2OH
C.X极区溶液的pH逐渐减小
D.每消耗1.0L0.50mol/L的H2O2电路中转移1.0mole-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com