
【题目】某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)
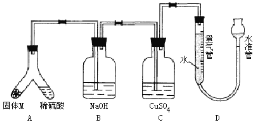
由上述实验事实可知:
(1)①固体M中一定有的物质是____________(填化学式) 理由是_________
②其中一种物质的质量可以确定为___________g(用代数式表示)。
(2)B装置的名称是________,B装置的作用_____________。
(3)C装置的作用是______,如果实验中没有B装置,则C装置中产生的现象是_______。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是____________。
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是_____________
A.M中有未反应的铁和硫 B.测定气体体积时水准管的水面高于量气管的水面
C.A中留有反应生成的气体 D.气体进入D装置前未用浓硫酸干燥
【答案】Fe、FeS B装置增重,说明吸收了H2S,故M 中有FeS;C无变化而量气管内有气体,说明H2生成,故M中有Fe ![]() 洗气瓶 吸收H2S 检验H2S已除尽 产生黑色沉淀 S 玻璃棒、漏斗 BC
洗气瓶 吸收H2S 检验H2S已除尽 产生黑色沉淀 S 玻璃棒、漏斗 BC
【解析】
(1)①据铁与硫在隔绝空气的条件下反应生成硫化亚铁,则所得固体M的成分可能有Fe、S、FeS,使稀硫酸(足量)与固体M充分反应,B装置增重,说明反应生成了硫化氢气体,固体M中一定有FeS;C装置中溶液无变化,说明硫化氢气体已被完全吸收,反应后进入了量气管气体的体积为VmL,说明还有另一种气体氢气生成,固体M中一定还有Fe。
故答案为:Fe、FeS;B装置增重,说明反应生成了硫化氢气体,固体M中一定有FeS;C装置中溶液无变化,说明硫化氢气体已被完全吸收,反应后进入了量气管气体的体积为VmL,说明还有另一种气体氢气生成,固体M中一定还有Fe;
②根据氢气的体积可以计算出铁的质量:n(Fe)=n(H2)=![]() mol,m(Fe)=
mol,m(Fe)=![]() mol
mol ![]() 56g/mol=
56g/mol=![]() g;
g;
(2)氢氧化钠能与酸反应,氢氧化钠溶液的作用是反应掉生成的硫化氢气体,故填洗气瓶,B装置的作用为:吸收H2S;
(3)C装置的作用是检验硫化氢气体是否被B完全吸收,完全吸收则C无变化,如C装置硫酸铜溶液中出现黑色沉淀,则硫化氢气体未被B完全吸收,故应填:检验H2S已除尽,产生黑色沉淀;
(4)稀硫酸和固体M的反应后溶液中还残留淡黄色固体,据硫的物理、化学性质该固体是硫,据过滤操作的实验知用到的玻璃仪器为:烧杯、漏斗、玻璃棒;
(5)如果A中留有气体,导致D中测量的气体减少,从而影响对剩余铁的计算;另外如果测定气体的体积时水面高于量气管,会导致量气管内气体压强增大,使测量的气体体积变小,导致Fe的计算量变小,所以答案选BC。


科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据所给的10种元素,完成以下各小题。
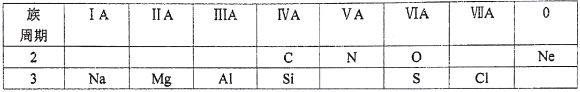
(1)镁的原子结构示意图为____。
(2)H2SO4与HClO4中,酸性较强的是____。
(3)NaOH与Al (OH)3中,属于两性氢氧化物的是____。它常用作治疗胃酸(含盐酸)过多的药物,该反应的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的镁分别在足量的二氧化碳、氧气中燃烧,有关叙述正确的是( )
A.在二氧化碳中燃烧产生的固体质量大
B.在氧气中产生的氧化镁质量大
C.氧化剂与还原剂物质的量之比都是2∶1
D.反应中都是氧元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学通过对比实验了解Na2CO3和NaHCO3性质的异同,下表是他们撰写的实验报告的一部分。
① | 在贴有标签a、b的试管中分别加入1.0g Na2CO3固体和NaHCO3固体,观察外观。 | / |
② | 继续向两试管中分别加入10.0mL水,用力振荡,观察现象。 | / |
③ | 再分别向两试管中滴加2滴酚酞溶液,观察现象。 | 溶液均变红,颜色较深的试管是 (填 “a”或“b”)。 |
④ | 最后分别向两溶液中滴加足量盐酸。 | 红色褪去,均有无色气体产生.经计算生成气体的是a b(填“>”“<”或“=”)。 |
⑤ | 加热大试管一段时间。(注:棉花球沾有无水硫酸铜粉末)
| / |
(1)请帮助该小组同学完成实验报告中放入内容_____________。
(2)已知:20℃时Na2CO3的溶解度为20.5g。由实验_______(填实验序号)现象可知,20℃时NaHCO3的溶解度小于20.5g;如果向饱和Na2CO3溶液中不断通入CO2气体,现象是________,化学方程式是_________。
(3)由实验⑤可以得出结论是_______,用化学方程式说明得出结论的原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含锂电解铝废渣(主要成分为LiF、AlF3、NaF,少量CaO等)为原料,生产高纯度LiOH的工艺流程如图:(已知:常温下,LiOH可溶于水,Li2CO3微溶于水)
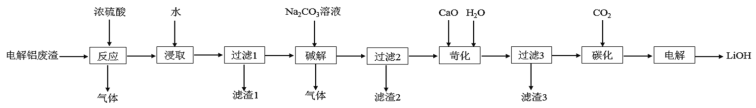
(1)含锂电解铝废渣与浓硫酸在200~400℃条件下反应2h。“滤渣1”主要成分是___(填化学式)。
(2)“过滤2”需要趁热在恒温装置中进行,否则会导致Li2SO4的收率下降,原因是___。
(已知部分物质的溶解度数据见下表)
温度/℃ | Li2SO4/g | Al2(SO4)3/g | Na2SO4/g |
0 | 36.1 | 31.2 | 4.9 |
10 | 35.4 | 33.5 | 9.1 |
20 | 34.8 | 36.5 | 19.5 |
30 | 34.3 | 40.4 | 40.8 |
40 | 33.9 | 45.7 | 48.8 |
(3)40°C下进行“碱解”,得到粗碳酸锂与氢氧化铝的混合滤渣,生成氢氧化铝的离子方程式为___;若碱解前滤液中c(Li+)=4molL-1,加入等体积的Na2CO3溶液后,Li+的沉降率到99%,则“滤液2”中c(CO32-)=___molL-1。[Ksp(Li2CO3)=1.6×10-3]
(4)“苛化”过程,若氧化钙过量,则可能会造成___。
(5)整个工艺流程中可以循环利用的物质有___。
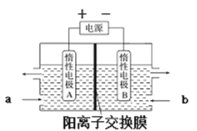
(6)“电解”原理如图所示。“碳化”后的电解液应从(填“a”或“b”)___口注入。阴极的电极反应式为___。
(7)高纯度LiOH可转化为电池级Li2CO3。将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.013×105 Pa下,测得的某些烷烃的沸点见下表。据表分析,下列说法正确的是( )
物质名称 | 沸点/℃ |
正丁烷CH3(CH2)2CH3 | -0.5 |
正戊烷CH3(CH2)3CH3 | 36.1 |
异戊烷 | 27.8 |
新戊烷 | 9.5 |
正己烷CH3(CH2)4CH3 | 69.0 |
A. 在标准状况时,新戊烷是气体
B. 在1.013×105 Pa、20 ℃时,C5H12都是液体
C. 烷烃随碳原子数增加,沸点降低
D. C5H12随支链增加,沸点降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是__________。
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________、________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是_______________。
②E处干燥管中盛放的药品是碱石灰,其作用是_____________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量_____________(填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室某硫酸试剂瓶标签上的部分内容,据此下列说法正确的是( )

A.该硫酸的物质的量浓度为9.2mol/L
B.该硫酸与等体积的水混合所得溶液的质量分数等于49%
C.配制500mL4.6mol/L的稀硫酸需取该硫酸125.0mL
D.1molFe与足量的稀硫酸反应,标准状况下产生44.8L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。下列叙述中不正确的是( )

A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C.用图乙装置测定反应速率,可测定反应产生的气体体积及反应时间
D.为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com