
【题目】I.由三种元素组成的化合物A,式量在200- -300之间。在一 定条件下A能发生如下图的转化,其中B的焰色反应为紫色(透过蓝色钴玻璃),C是不溶于酸的白色沉淀。

请回答∶
(1) C的化学式是______,组成A的三种元素是________。
(2) A加热分解的化学方程式是_____。
(3) E可以和SCl2反应生成一种常用于有机合成的物质SOCl2和另一种常见气体,反应的化学方程式是________。
II.实验室测定某铁铝合金中的铝含量,利用如图装置和试剂完成。

请回答∶
(1)下列有关该实验的说法中正确的是_______。
A.由于恒压分液漏斗的存在,该装置不能进行气密性检查
B.读数前需将量气管C上下移动使B、C中的液面相平
C.反应完成后生成的氢气都要转移至装置B中
D.需要控制NaOH的量以防止产生气体过多超过量气装置的量程
(2)若将恒压分液漏斗(A) 去掉导管a,改成普通分液漏斗,则测得铁铝合金中的铝含量______,(填“偏大”、“偏小”或“不变”),请说明理由_____。
【答案】BaSO4 K、S、O 2K2S2O8 2K2SO4+2SO3↑+O2↑ SO3+SCl2= SOCl2+ SO2 B 偏大 滴入锥形瓶中的液体排开的气体使量气装置中气体体积增大,导致计算的铝含量增多。
2K2SO4+2SO3↑+O2↑ SO3+SCl2= SOCl2+ SO2 B 偏大 滴入锥形瓶中的液体排开的气体使量气装置中气体体积增大,导致计算的铝含量增多。
【解析】
Ⅰ.固体A隔绝空气加热,得到固体B,焰色反应为紫色,说明其含有K元素;与足量的BaCl2反应得到白色不溶于酸的沉淀,则固体C为BaSO4,固体B为K2SO4;混合气体D,冷却后得到固体E,E能与BaCl2溶液得到BaSO4沉淀,则E为SO3;由此可知,这三种元素为K、S、O,则另一种气体单质为O2。
Ⅱ.铁铝合金中,Al会与NaOH反应生成H2,通过生成氢气的量求出Al的质量,从而求出铝的含量。
Ⅰ.根据分析,固体A含有元素分别为K、S、O;固体B为K2SO4,固体B与BaCl2溶液反应后得到BaSO44.66g,其物质的量![]() ,根据关系式n(K)~2n(SO42-),则5.40gA中K的质量
,根据关系式n(K)~2n(SO42-),则5.40gA中K的质量![]() ;固体A中的S元素均转化为BaSO4中的硫元素,一共得到BaSO4的质量为4.66g+4.66g=9.32g;则5.40gA中S的质量
;固体A中的S元素均转化为BaSO4中的硫元素,一共得到BaSO4的质量为4.66g+4.66g=9.32g;则5.40gA中S的质量![]() ;根据质量守恒,5.40gA中O的质量
;根据质量守恒,5.40gA中O的质量![]() ;则物质A中各元素原子的比例
;则物质A中各元素原子的比例![]() ,A的最简式为KSO4,式量在200--300之间,则A的分子式为K2S2O8;
,A的最简式为KSO4,式量在200--300之间,则A的分子式为K2S2O8;
(1)C的化学式为BaSO4;组成A的三种元素为K、S、O;
(2)根据流程图,A物质分解得到K2SO4、SO3、O2。5.4gA的物质的量![]() ,根据得到固体C的质量可知,得到SO3和K2SO4的物质的量均为0.02mol,根据O2的体积可知,分解得到O2的物质的量为0.01mol,在化学方程式中,各物质的物质的量之比等于计量数之比,则可得化学方程式为2K2S2O8
,根据得到固体C的质量可知,得到SO3和K2SO4的物质的量均为0.02mol,根据O2的体积可知,分解得到O2的物质的量为0.01mol,在化学方程式中,各物质的物质的量之比等于计量数之比,则可得化学方程式为2K2S2O8 2K2SO4+2SO3↑+O2↑;
2K2SO4+2SO3↑+O2↑;
(3)SO3和SCl2反应得到SOCl2,SOCl2中S的化合价为+4。SCl2中S的化合价为+2,SO3中S的化合价为+6,在+2和+6之间只有+4,根据化合价只能靠近不能交叉的原则,则该反应另一种产物中S的化合价也为+4,是SO2,化学方程式为SO3+SCl2=SOCl2+SO2;
II.(1)A.该实验是通过测量气体的体积,来测定合金中Al的含量,因此气密性必须良好,A错误;
B.气体体积和压强有关,为了正确测量气体的体积,内外压强需相等,因此左右两边的液面差相等,B正确;
C.由于反应前装置中就有空气,生成的氢气会把空气排出,因此不必把生成的氢气转移至B中,C错误;
D.若生成的氢气过多,超过了量气装置的量程,则无法测得生成氢气的体积,但是要保证合金中的Al完全反应才能计算出Al的含量,NaOH必须足量,因此需要控制合金的用量,以防止生成的气体过多,D错误;
答案选B;
(2)若改为普通分液漏斗,则放入锥形瓶中的NaOH溶液的体积也会被算作生成氢气的体积,从而使计算出的Al质量偏大,铁铝合金中铝含量偏大。


科目:高中化学 来源: 题型:
【题目】甲醇来源丰富,价格低廉,是一种重要的化工原料,有着非常重要、广泛的用途。工业上通常用水煤气在恒容、催化剂和加热的条件下生产甲醇,其热化学方程式为:
2H2(g)+CO(g)![]() CH3OH(g) ΔH=-90.8kJ/mol。
CH3OH(g) ΔH=-90.8kJ/mol。
(1)该反应的平衡常数表达式为:K=______,如升高温度,K值将_____(填:增大、减小或不变)。
(2)以下各项不能说明该反应达到平衡状态的是____________.
A、混合气体的密度保持不变 B、甲醇的质量分数保持不变
C、CO的浓度保持不变 D、2v逆(H2)=v正(CH3OH)
(3)在2100C、2400C和2700C三种不同温度、2L恒容密闭容器中研究合成甲醇的规律。
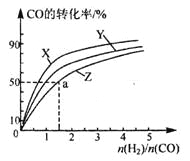
上图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系,则曲线Z对应的温度是____________。由起始达到a点所需时间为5min,则H2的反应速率____________mol/(L·min)。
(4)某兴趣小组设计了如图所示的甲醇燃料电池装置。

①该电池工作时,正极是_____极(填“a”或 “b”);
②该电池负极反应的离子方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应aA(g)+bB(g)![]() cC(g) ΔH,在密闭容器中进行。如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况。下列推断中正确的是
cC(g) ΔH,在密闭容器中进行。如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况。下列推断中正确的是
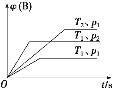
A. p1<p2,T1>T2,a+b<c,ΔH>0
B. p1<p2,T1>T2,a+b>c,ΔH>0
C. p1>p2,T1<T2,a+b<c,ΔH<0
D. p1>p2,T1<T2,a+b>c,ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述不正确的是( )
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在1nm100nm之间
B.用平行光照射CuSO4溶液和Fe(OH)3胶体,可以加以区分
C.把FeCl3饱和溶液滴入到NaOH溶液中,以制取Fe(OH)3胶体
D.树林中的晨曦,该现象与丁达尔效应有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4是两种主要的温室气体。以CH4和CO2为原料制造更高价值的化学产品是用来缓解温室效应的研究方向,回答下列问题。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。
已知:①CH3OH(g) + 3/2 O2(g) = CO2(g) + 2H2O(l) H1= a kJ/mol②H2(g) + 1/2 O2(g) = H2O(l) H2= b kJ/mol ③H2O(g) = H2O(l) H3= c kJ/mol,则CO2和H2反应生成CH3OH和水蒸气的热化学方程式为_____。
(2)用Cu2Al2O4作催化剂制备乙酸。已知:CO2(g)+CH4(g)![]() CH3COOH(g) H2=akJ/mol。
CH3COOH(g) H2=akJ/mol。
①各物质相对能量大小如图所示,则a=___。
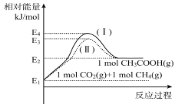
②该反应的速率方程可表示为:v(正)=k正c(CO2)c(CH4)和v(逆)=k逆c(CH3COOH),k正和k逆在一定温度时为常数,分别称作正,逆反应速率常数,请写出用k正,k逆表示的平衡常数的表达式K=___。
(3)将CO2和CH4在一定条件下反应可制得工业合成气,在1 L 密闭容器中通入CH4与CO2,使其物质的量浓度为1.0 mol/L,在一定条件下发生反应:CH4(g) + CO2(g) 2CO(g) + 2H2(g),测得CH4的平衡转化率与温度及压强的关系如下图所示:
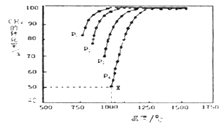
则:
①压强P1,P2,P3,P4由大到小的关系为___。
②对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),如果P4=2 MPa,求x点的平衡常数Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③下列措施中能使平衡体系中c(CO)/c(CO2)减小的是__。
A.升高温度 B.增大压强
C.保持温度、压强不变,充入He D.恒温、恒容,再充入1 mol CO2和1 mol CH4
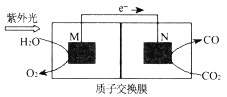
(4)科学家还研究了其他转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO(电解质溶液为稀硫酸),该装置工作时,N___极的电极反应式为______,若导线中通过电子为a mol,则M极电解质溶液中H+改变量为___mol,N极电解质溶液m=__g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在指定条件下,下列各组离子一定能大量共存的是
A.滴加甲基橙显红色的溶液中:Na+、Fe2+、C1-、NO![]()
B.0.1mol·L-1FeC13溶液中:NH![]() 、Mg2+、SO
、Mg2+、SO![]() 、NO
、NO![]()
C.0.1mo1·L-1KI溶液中:Na+、K+、ClO-、OH-
D.由水电离的c(H+)=1.0×10-13 mo1·L-1的溶液中:K+、NH![]() 、C1-、HCO
、C1-、HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表,下列说法正确的是
4NO2(g)+O2(g) ΔH >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表,下列说法正确的是
时间/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/mol·L-1 | 5.00 | 3.50 | 2.50 | 2.50 |
A. 500 s内NO2的生成速率为3.00×10-3 mol·L-1·s-1
B. T1温度下该反应平衡时N2O5的转化率为50%
C. 达平衡后其他条件不变,将容器体积压缩到原来的![]() ,c(N2O5)<5.00 mol·L-1
,c(N2O5)<5.00 mol·L-1
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、F、Cu及其化合物在化工、医药、材料等方面应用十分广泛。回答下列有关问题:
(1)N原子中最高能级的电子的电子云轮廓图为___________;基态Cu+的核外电子排布式为____________。
(2)化合物(CH3)3N可用于制备医药、农药。分子中N原子杂化方式为________,该物质能溶于水的原因是_____________________。
(3)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,其阳离子的空间构型为_____________,写出一种与[H2F]+互为等电子体的分子______________(写化学式)。
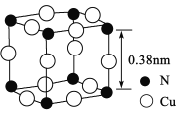
(4)氮、铜形成的一种化合物的晶胞结构如图所示。与每个Cu原子紧邻的Cu原子有____个,令阿伏加德罗常数的值为NA,该晶体的密度为______g/cm3。(列出计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液。
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体________g。
(2)从下图中选择称量NaOH固体所需要的仪器(填字母):________。

Ⅱ.测定稀硫酸和稀NaOH中和热的实验装置如下图所示。

(1)写出该反应的热化学方程式(中和热ΔH=-57.3 kJ·mol-1): _______________。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:

1_______________2___________________3_______________________4________________________5温度差平均值____
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则中和热ΔH=________(取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是________(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com