
【题目】CO2和CH4是两种主要的温室气体。以CH4和CO2为原料制造更高价值的化学产品是用来缓解温室效应的研究方向,回答下列问题。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。
已知:①CH3OH(g) + 3/2 O2(g) = CO2(g) + 2H2O(l) H1= a kJ/mol②H2(g) + 1/2 O2(g) = H2O(l) H2= b kJ/mol ③H2O(g) = H2O(l) H3= c kJ/mol,则CO2和H2反应生成CH3OH和水蒸气的热化学方程式为_____。
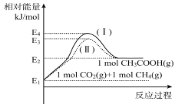
(2)用Cu2Al2O4作催化剂制备乙酸。已知:CO2(g)+CH4(g)![]() CH3COOH(g) H2=akJ/mol。
CH3COOH(g) H2=akJ/mol。
①各物质相对能量大小如图所示,则a=___。
②该反应的速率方程可表示为:v(正)=k正c(CO2)c(CH4)和v(逆)=k逆c(CH3COOH),k正和k逆在一定温度时为常数,分别称作正,逆反应速率常数,请写出用k正,k逆表示的平衡常数的表达式K=___。
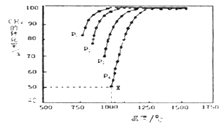
(3)将CO2和CH4在一定条件下反应可制得工业合成气,在1 L 密闭容器中通入CH4与CO2,使其物质的量浓度为1.0 mol/L,在一定条件下发生反应:CH4(g) + CO2(g) 2CO(g) + 2H2(g),测得CH4的平衡转化率与温度及压强的关系如下图所示:
则:
①压强P1,P2,P3,P4由大到小的关系为___。
②对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),如果P4=2 MPa,求x点的平衡常数Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③下列措施中能使平衡体系中c(CO)/c(CO2)减小的是__。
A.升高温度 B.增大压强
C.保持温度、压强不变,充入He D.恒温、恒容,再充入1 mol CO2和1 mol CH4
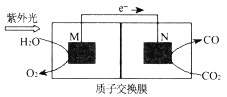
(4)科学家还研究了其他转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO(电解质溶液为稀硫酸),该装置工作时,N___极的电极反应式为______,若导线中通过电子为a mol,则M极电解质溶液中H+改变量为___mol,N极电解质溶液m=__g。
【答案】CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g) H=(3b-a-c)kJ/mol E2-E1
CH3OH(g) +H2O(g) H=(3b-a-c)kJ/mol E2-E1 ![]() P4>P3>P2>P1
P4>P3>P2>P1 ![]() (MPa)2 BD 正 CO2+2H++2e-=CO+H2O 0 9a
(MPa)2 BD 正 CO2+2H++2e-=CO+H2O 0 9a
【解析】
(1)根据盖斯定律进行分析;
(2)①根据图示可知,该反应为吸热反应,H2=生成物总能量-反应物总能量;
②CO2(g)+CH4(g)![]() CH3COOH(g),平衡常数的表达式K=c(CH3COOH)/c(CH4)c(CO2);反应达到平衡后,v(正)= v(逆),据此可以求出K。
CH3COOH(g),平衡常数的表达式K=c(CH3COOH)/c(CH4)c(CO2);反应达到平衡后,v(正)= v(逆),据此可以求出K。
(3) ①该反应正反应是气体体积增大的反应,增大压强平衡向逆反应进行,甲烷的转化率降低,据此分析压强的大小;
②对于气相反应,用某组分(B)的平衡压强P(B)代替物质的量浓度c(B)也可表示平衡常数(记作KP),则该反应的平衡常数的表达式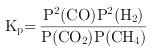 ;结合化学平衡三段式列式计算;
;结合化学平衡三段式列式计算;
③从图示可知,温度升高,甲烷的转化率增大,所以CH4(g) + CO2(g) 2CO(g) + 2H2(g),反应为吸热反应;根据平衡移动规律进行分析;
(4)根据装置中电子流向知,M是负极,N是正极;正极反应式为:CO2+2H++2e-=CO+H2O;M电极反应为:2H2O-4e-=O2+4H+,总反应式为:2CO2= 2CO+ O2;根据导线中通过电子为a mol,分析M极电解质溶液中H+改变量、N极电解质溶液m。
(1)已知①CH3OH(g) + 3/2 O2(g) = CO2(g) + 2H2O(l) H1= a kJ/mol;②H2(g) + 1/2 O2(g) = H2O(l) H2= b kJ/mol ;③H2O(g) = H2O(l) H3= c kJ/mol,根据盖斯定律知, ②×3-①-③得:CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g) H=(3b-a-c)kJ/mol;
CH3OH(g) +H2O(g) H=(3b-a-c)kJ/mol;
故答案是: CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g) H=(3b-a-c)kJ/mol;
CH3OH(g) +H2O(g) H=(3b-a-c)kJ/mol;
(2)①根据图示可知,该反应为吸热反应,H2=生成物总能量-反应物总能量 = E2-E1=a kJ/mol;
故答案是:E2-E1;
②CO2(g)+CH4(g)![]() CH3COOH(g),平衡常数的表达式K=c(CH3COOH)/c(CH4)c(CO2);反应达到平衡后,v(正)= v(逆),所以k正c(CO2)c(CH4)= k逆c(CH3COOH),因此
CH3COOH(g),平衡常数的表达式K=c(CH3COOH)/c(CH4)c(CO2);反应达到平衡后,v(正)= v(逆),所以k正c(CO2)c(CH4)= k逆c(CH3COOH),因此![]() = c(CH3COOH)/c(CH4)c(CO2)= K;
= c(CH3COOH)/c(CH4)c(CO2)= K;
故答案是: (3) ①由图可以知道,温度一定时,甲烷的转化率α(P1)> α(P2)> α(P3) >α(P4),该反应正反应是气体体积增大的反应,增大压强平衡向逆反应进行,甲烷的转化率降低,故压强P4>P3>P2>P1; 故答案是: P4>P3>P2>P1; ②对于气相反应,用某组分(B)的平衡压强P(B)代替物质的量浓度c(B)也可表示平衡常数(记作KP),则该反应的平衡常数的表达式 CH4(g) + CO2(g) 2CO(g) + 2H2(g) 起始量(mol) 1 1 0 0 变化量(mol) 0.5 0.5 1 1 平衡量(mol) 0.5 0.5 1 1 平衡气体总物质的量=3mol,如果P4=2 MPa,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,则a点的平衡常数KP=[(2×1/3)2×(2×1/3)2]÷(2×0.5/3)2= 故答案是: ③从图示可知,温度升高,甲烷的转化率增大,所以CH4(g) + CO2(g) 2CO(g) + 2H2(g),反应为吸热反应; A.升高温度,平衡右移,c(CO2)减小,c(CO)增大,所以c(CO)/c(CO2)增大,故A错误; B.该反应正反应是气体体积增大的反应,增大压强平衡向逆反应进行,c(CO2)增大,c(CO)减小,所以c(CO)/c(CO2)减小,故B正确; C.保持温度、压强不变,充入He,气体体积增大,平衡向右移动,c(CO2)减小,c(CO)增大,所以c(CO)/c(CO2)增大,故C错误; D.恒温、恒容,再充入1 mol CO2和1 mol CH4,与原平衡相比等效于加压过程,平衡左移,c(CO2)增大,c(CO)减小,所以c(CO)/c(CO2)减小,故D正确; 故答案是:BD。 (4)该装置中,根据电子流向知,M是负极,N是正极;正极发生还原反应,反应式为:CO2+2H++2e-=CO+H2O;M电极反应为:2H2O-4e-=O2+4H+,总反应式为:2CO2= 2CO+ O2;故导线中通过电子为a mol,则M极电解质溶液中H+改变量为amol;根据CO2+2H++2e-=CO+H2O反应可知,导线中通过电子为a mol时, N极电解质溶液增加量为m=(22a+a)-14a=9ag; 故答案是:正;CO2+2H++2e-=CO+H2O;0;9a。![]() ;
;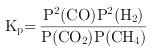 ;结合化学平衡三段式列式计算,设体积为1L,a点甲烷转化率为50%;
;结合化学平衡三段式列式计算,设体积为1L,a点甲烷转化率为50%;![]() (MPa)2 ;
(MPa)2 ;![]() (MPa)2 ;
(MPa)2 ;


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】实验室需要95 mL l.0 mol/L稀硫酸,现用98%的浓硫酸(其密度为1.84 g.mL-l)来配制。
(1)实验需要的玻璃仪器有50 mL烧杯、玻璃棒、胶头滴管、____、____。
(2)玻璃棒的作用为____,胶头滴管的作用为________,
(3)配制过程中,下列情况会使配制结果偏低的是(填序号)____。
A.将稀释的硫酸液转移至容量瓶后,洗涤烧杯和玻璃棒2-3次。
B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外。
C.容量瓶使用时未干燥。
D.用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度相切。
E.未冷却至室温就定容。
F.定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.72g金属钠、氧化钠和过氧化钠的混合物与足量水反应,在标准状况下得到672mL混合气体,将混合气体电火花点燃,恰好完全反应,则原混合物中钠、氧化钠、过氧化钠的物质的量之比为( )
A. 3:2:1 B. 4:2:1 C. 2:1:1 D. 1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若含有1 mol铁离子和1 mol铝离子的混合溶液,现按下图横坐标依次加入8 mol 氢氧化钠溶液、1 mol盐酸,通入1 mol 二氧化碳气体,纵坐标为混合沉淀的物质的量。

(1)请画出沉淀的量随反应的变化曲线______________。
(2)并写出加入氢氧化钠6 mol及其后发生的各步反应的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下平衡:2SO2(g)+O2(g)2SO3(g) △H= QkJ/mol(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述平衡的影响,下列分析正确的是

A. 图I研究的是t0时刻增大O2的浓度对平衡的影响
B. 图II研究的是t0时刻加入催化剂后对反应速率和平衡的影响
C. 图III研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图III研究的是温度对化学平衡的影响,且乙的温度较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.由三种元素组成的化合物A,式量在200- -300之间。在一 定条件下A能发生如下图的转化,其中B的焰色反应为紫色(透过蓝色钴玻璃),C是不溶于酸的白色沉淀。

请回答∶
(1) C的化学式是______,组成A的三种元素是________。
(2) A加热分解的化学方程式是_____。
(3) E可以和SCl2反应生成一种常用于有机合成的物质SOCl2和另一种常见气体,反应的化学方程式是________。
II.实验室测定某铁铝合金中的铝含量,利用如图装置和试剂完成。

请回答∶
(1)下列有关该实验的说法中正确的是_______。
A.由于恒压分液漏斗的存在,该装置不能进行气密性检查
B.读数前需将量气管C上下移动使B、C中的液面相平
C.反应完成后生成的氢气都要转移至装置B中
D.需要控制NaOH的量以防止产生气体过多超过量气装置的量程
(2)若将恒压分液漏斗(A) 去掉导管a,改成普通分液漏斗,则测得铁铝合金中的铝含量______,(填“偏大”、“偏小”或“不变”),请说明理由_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是
A.14gCO、N2混合气体中共含有7NA个电子
B.常温下,0.1mol环氧乙烷(![]() )共有0.3NA个共价键
)共有0.3NA个共价键
C.在含CO![]() 总数为NA的Na2CO3溶液中,Na+总数为2NA
总数为NA的Na2CO3溶液中,Na+总数为2NA
D.氢氧燃料电池正极消耗22.4L气体时,负极消耗的气体分子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土铈(Ce)元素主要存在于独居石中,金属铈化学性质十分活泼。近年来发现用铈(Ce)的氧化物可高效制取H2,制备原理如图所示,已知0<![]() <2,下列说法不正确的是
<2,下列说法不正确的是

A.CeO2是水分解的催化剂
B.T<1050℃时,CeO2比CeO2—δ稳定
C.工业上可用电解CeCl4溶液制备Ce
D.过程②的方程式为CeO 2—δ+δH2O![]() CeO2+δH2
CeO2+δH2
查看答案和解析>>
科目:高中化学 来源: 题型:
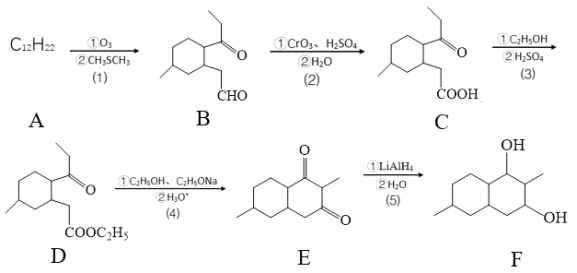
【题目】下列有关化学合物(F)的合成路线如下:
已知: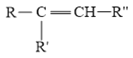
![]()
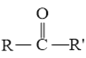 +R″-CHO
+R″-CHO
回答下列问题:
(1)化合物D官能团的名称是_________________。
(2)反应⑸的反应类型是____________。
(3)化合物A的键线式是____________。
(4)化合物B与新制的Cu(OH)2悬浊液反应的化学方程:____________。
(5)碳原子上连有4个不同的原子或原子团,该碳称为手性碳,则化合物C的手性碳原子数有____个。
(6)芳香化合物G是化合物E的同分异构体,且G满足以下两个条件:
①1molG与足量金属钾反应,在标准状况下放出22.4LH2;
②有三种不同化学环境的氢原子且它们的原子个数比为6:2:1。
则G可能的结构简式____________。
⑺设计由![]() 制备
制备 的合成路线________。
的合成路线________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com