
【题目】对于反应4CO(g)+2NO2(g)![]() N2(g)+4CO2(g),以下化学反应速率的表示中,所表示反应速率最快的是
N2(g)+4CO2(g),以下化学反应速率的表示中,所表示反应速率最快的是
A. v(CO)=1.6 mol·(L·min) -1B. v(NO2)=0.9 mol·(L·min) -1
C. v(N2)=0.25mol·(L·min) -1D. v(CO2)=1.2 mol·(L·min) -1
科目:高中化学 来源: 题型:
【题目】在工业上常用CO与H2合成甲醇,热化学方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=-574.4 kJ·mol-1。
CH3OH(g) ΔH=-574.4 kJ·mol-1。
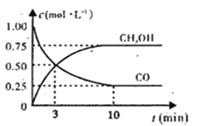
(1)下图是表示一定温度下,在体积为2L的密闭容器中加入5mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。反应第10分钟达到平衡,从反应开始到平衡,用H2表示平均反应速率v(H2)=__mol/(L·min),且反应前后体系的压强之比为____。
(2)在一容积可变的密闭容器中充有10 mol CO和20 mol H2。CO的平衡转化率与温度(T)、压强(p)的关系如图所示。
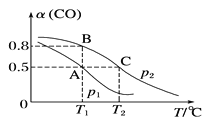
①A、B、C三点对应的平衡常数KA、KB、KC的大小关系为_____。
②若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种新型能源,被誉为“21世纪的清洁燃料”。
(1)用CO和H2合成二甲醚的反应为:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)△H。
CH3OCH3(g)+CO2(g)△H。
几种物质的相对能量如下:
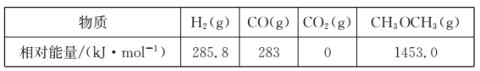
△H=______kJ·mo1。改变下列“量”,一定会引起△H发生变化的是_____(填代号)。
A.温度 B.反应物浓度 C.催化剂 D.化学计量数
(2)有利于提高反应中CH3OCH3产率的条件为_______(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(3)采用新型催化剂(主要成分是Cu—Mn的合金)制备二甲醚。催化剂中n(Mn)/n(Cu)对合成二甲醚的影响情况如下图所示。
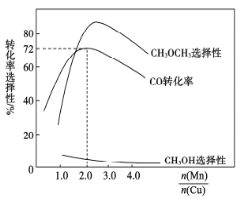
当n(Mn)/n(Cu)=2时,二甲醚的选择性(![]() )为85.8%,此时二甲醚的产率为_________。
)为85.8%,此时二甲醚的产率为_________。
(4)用二甲醚燃料电池电解法可将酸性含铬废水(主要含有Cr2O72-)转化为Cr3+。原理如下图:
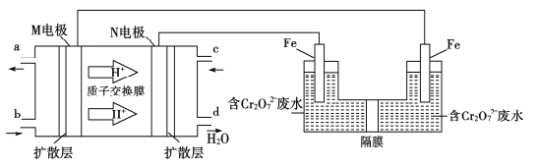
①燃料电池中的负极是______(填“M”或“N”)电极。电解池阴极的电极反应式为______________________________。
②消耗6.9g二甲醚时可处理Cr的含量为26.0g·L-1的废水1L,该套装置的能量利用率为___________。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25 ℃、101 kPa下,0.5 mol辛烷C8H8燃烧生成二氧化碳和液态水时放出2 759 kJ热量。表示上述反应的热化学方程式正确的是( )
A. C8H18(l)+![]() O2(g)===8CO2(g)+9H2O(g) ΔH=-48.40 kJ·mol-1
O2(g)===8CO2(g)+9H2O(g) ΔH=-48.40 kJ·mol-1
B. C8H18(l)+![]() O2(g)===8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
O2(g)===8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
C. C8H18(l)+![]() O2(g)===8CO2(g)+9H2O(l) ΔH=+5 518 kJ·mol-1
O2(g)===8CO2(g)+9H2O(l) ΔH=+5 518 kJ·mol-1
D. 2C8H18(l)+25O2(g)===16CO2(g)+18H2O(l) ΔH=+11 036 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发展新能源、改善空气质量等一直是化学研究的热点。回答下列问题:
(1)甲醇是可再生的清洁能源,可利用CO2与H2合成甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。该反应历程如图所示。

上述合成甲醇的反应的有机副产物有__________;由于该反应速率较慢,需要加入催化剂使反应速率加快,主要降低下列变化中________(填字母)的能量变化。
A.*CO+*OH→*CO+*H2O B.*CO→*OCH
C.*OCH2→*OCH3 D.*OCH3→*CH3OH
(2)焦炭与水蒸气在恒容密闭容器中反应,可制合成气,主要反应(I)、(II)的lg KP(KP为以分压表示的平衡常数)与T的关系如图所示。

①反应(I)的△H______0(填“>”、“=”或“<”);
②在容积为10 L密闭容器中充入1 mol CO、1 mol H2O只发生反应(II),反应5分钟到达图中d点,请计算0~5 min时,CO平均反应速率________;此时CO的转化率为________;已知:反应速率v=v正-v逆=k正·x(CO)·x(H2O)-k逆·x(CO2)·x(H2),k正、k逆分别为正、逆反应速率常数,x为物质的量分数,计算e处的![]() =______;
=______;
③c点时,若反应容器中CO浓度为0.1 mol/L,则CO2浓度为________(填数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知2 mol氢气燃烧生成液态水时放出572 kJ热量,反应方程式是
2H2(g)+O2(g)==2H2O(l)
(l)请回答下列问题:
①该反应的生成物能量总和________(填“大于”、“小于”或“等于”)反应物能量总和。
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量________(填“>”、“<”或“=”)572 kJ。
③与化石燃料相比,利用氢能源有很多优点,请说出其中一点______________________。
(2)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喘通(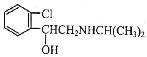 )是我国最早自主研发生产的药物之一,主要用于支气管哮喘的治疗。其合成路线如图:
)是我国最早自主研发生产的药物之一,主要用于支气管哮喘的治疗。其合成路线如图:
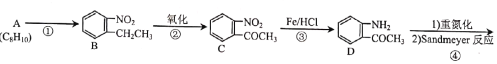
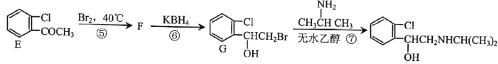
(1)A的化学名称为___,反应①的试剂与条件为__,反应③的反应类型为___。
(2)E中含氧官能团的名称为__。
(3)F的结构简式为___。
(4)反应⑦的化学方程式为__。
(5)B的同分异构体H是含有氨基、能与NaHCO3溶液反应放出气体的芳香族化合物。则H的结构有__种(不含立体异构)。其中核磁共振氢谱有5组峰,且峰面积之比为1:2:2:2:2的是__(写出其中一种的结构简式)。
(6)《神农本草经》中记载麻黄能“止咳逆上气”。从麻黄中提取的麻黄碱也可用于治疗支气管哮喘,其结构简式为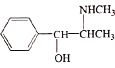 。
。
已知:![]() + CH3COCl
+ CH3COCl![]() +HCl。设计以苯、CH3CH2COCl、CH3NH2为原料合成麻黄碱的合成路线__。(无机试剂任选)
+HCl。设计以苯、CH3CH2COCl、CH3NH2为原料合成麻黄碱的合成路线__。(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6.72L标况下的氯气通入到500ml一定物质的量浓度的氢氧化钠溶液中,恰好完全反应。则
①该氢氧化钠溶液的浓度是多少?②生成次氯酸钠的质量是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com