
【题目】二甲醚(CH3OCH3)是一种新型能源,被誉为“21世纪的清洁燃料”。
(1)用CO和H2合成二甲醚的反应为:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)△H。
CH3OCH3(g)+CO2(g)△H。
几种物质的相对能量如下:
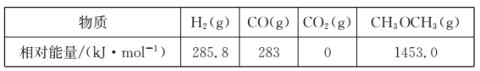
△H=______kJ·mo1。改变下列“量”,一定会引起△H发生变化的是_____(填代号)。
A.温度 B.反应物浓度 C.催化剂 D.化学计量数
(2)有利于提高反应中CH3OCH3产率的条件为_______(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(3)采用新型催化剂(主要成分是Cu—Mn的合金)制备二甲醚。催化剂中n(Mn)/n(Cu)对合成二甲醚的影响情况如下图所示。
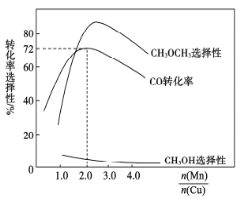
当n(Mn)/n(Cu)=2时,二甲醚的选择性(![]() )为85.8%,此时二甲醚的产率为_________。
)为85.8%,此时二甲醚的产率为_________。
(4)用二甲醚燃料电池电解法可将酸性含铬废水(主要含有Cr2O72-)转化为Cr3+。原理如下图:
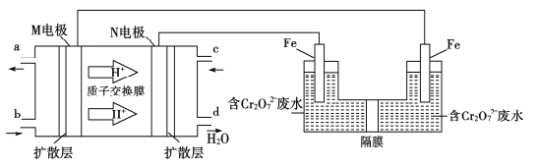
①燃料电池中的负极是______(填“M”或“N”)电极。电解池阴极的电极反应式为______________________________。
②消耗6.9g二甲醚时可处理Cr的含量为26.0g·L-1的废水1L,该套装置的能量利用率为___________。(保留3位有效数字)
【答案】-253.4 D B 61.8% M Cr2O![]() +6e-+14H+===2Cr3++7H2O 83.3%
+6e-+14H+===2Cr3++7H2O 83.3%
【解析】
根据反应热△H=生成物总能量-反应物总能量进行计算;根据影响化学平衡移动因素进行分析;根据二甲醚的选择性计算公式:![]() 进行计算;根据氢离子移动方向判断正负极,根据电子守恒计算能量的利用率。
进行计算;根据氢离子移动方向判断正负极,根据电子守恒计算能量的利用率。
(1)用CO和H2合成二甲醚的反应为:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)△H=生成物总能量-反应物总能量=1453.0 kJ·mo1-1-(3
CH3OCH3(g)+CO2(g)△H=生成物总能量-反应物总能量=1453.0 kJ·mo1-1-(3![]() 285.8kJ·mo1-1+3
285.8kJ·mo1-1+3![]() kJ·mo1-1)=-253.4 kJ·mo1-1;
kJ·mo1-1)=-253.4 kJ·mo1-1;
A.改变温度会影响化学反应平衡移动,但不会影响△H,故 A不符合题意;
B.改变反应物浓度,影响化学反应平衡移动,但不会影响△H ,故 B不符合题意;
C.催化剂只改变化学反应速率,不会影响△H,故C不符合题意;
D.反应热与化学反应计量数成正比,所以改变化学计量数会影响△H,故 D符合题意;
故答案:-253.4;D;
(2) 根据3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)△H=-253.4 kJ·mo1-1可知,升高温度,平衡逆向移动,CH3OCH3产率降低,降低温度,平衡正向移动,CH3OCH3产率升高;增大压强,平衡正向移动,CH3OCH3产率升高,降低压强,平衡逆向移动,CH3OCH3产率降低;所以有利于提高反应中CH3OCH3产率的条件为低温高压,故B正确;故答案:B。
CH3OCH3(g)+CO2(g)△H=-253.4 kJ·mo1-1可知,升高温度,平衡逆向移动,CH3OCH3产率降低,降低温度,平衡正向移动,CH3OCH3产率升高;增大压强,平衡正向移动,CH3OCH3产率升高,降低压强,平衡逆向移动,CH3OCH3产率降低;所以有利于提高反应中CH3OCH3产率的条件为低温高压,故B正确;故答案:B。
(3) 当![]() =2时,二甲醚的选择性(
=2时,二甲醚的选择性(![]() )为85.8%,由图可知CO的转化率为72%,此时二甲醚的产率=85.8%
)为85.8%,由图可知CO的转化率为72%,此时二甲醚的产率=85.8%![]() =61.8%,故答案:61.8%;
=61.8%,故答案:61.8%;
(4)①由质子交换膜中氢离子移动方向可知,M为负极,N为正极;电解池中与正极相连为阳极发生氧化反应,与负极相连的极为阴极发生还原反应,所以反应的电极反应式为:Cr2O![]() +6e-+14H+===2Cr3++7H2O,故答案:M;Cr2O
+6e-+14H+===2Cr3++7H2O,故答案:M;Cr2O![]() +6e-+14H+===2Cr3++7H2O;
+6e-+14H+===2Cr3++7H2O;
②n(CH3OCH3)=![]() ,根据 电子守恒:CH3OCH3 - 12e-+3H2O= 2CO2↑+12H+可知转移电子为
,根据 电子守恒:CH3OCH3 - 12e-+3H2O= 2CO2↑+12H+可知转移电子为![]() 12,可以还原m(Cr)=26.0g·L-1
12,可以还原m(Cr)=26.0g·L-1![]() 1L=26.0g,根据Cr2O
1L=26.0g,根据Cr2O![]() +6e-+14H+===2Cr3++7H2O可知转移的电子=
+6e-+14H+===2Cr3++7H2O可知转移的电子=![]() =1.5mol,该套装置的能量利用率=
=1.5mol,该套装置的能量利用率=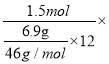 100%=83.3%,故答案为: 83.3%。
100%=83.3%,故答案为: 83.3%。


科目:高中化学 来源: 题型:
【题目】下列关于工业制备方法与化学方程式均正确的是( )
A.工业上用电解饱和食盐水的方法制取氯气:2NaCl![]() 2Na + Cl2↑
2Na + Cl2↑
B.工业上用乙醇在浓硫酸的作用下制取乙烯: CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
C.工业上用氢气还原四氯化硅制得高纯度的硅:SiCl4+2H2![]() Si+4HCl
Si+4HCl
D.工业以硫黄为原料生产硫酸,沸腾炉中的主要反应: 2S+3O2![]() 2SO3
2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在指定条件下,下列各组离子一定能大量共存的是
A.滴加甲基橙显红色的溶液中:Na+、Fe2+、C1-、NO![]()
B.0.1mol·L-1FeC13溶液中:NH![]() 、Mg2+、SO
、Mg2+、SO![]() 、NO
、NO![]()
C.0.1mo1·L-1KI溶液中:Na+、K+、ClO-、OH-
D.由水电离的c(H+)=1.0×10-13 mo1·L-1的溶液中:K+、NH![]() 、C1-、HCO
、C1-、HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2 L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:xA(g)+yB(g)pC(g)+qD(g)已知:平均反应速率v(C)=![]() v(A);反应2 min时,A的浓度减少了
v(A);反应2 min时,A的浓度减少了![]() a mol,B的物质的量减少了
a mol,B的物质的量减少了![]() mol,有a mol D生成。
mol,有a mol D生成。
回答下列问题:
(1)反应2 min内,v(A)=________,v(B)=________。
(2)化学方程式中,x=________,y=________,p=________,q=________。
(3)反应平衡时,D为2a mol,则B的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
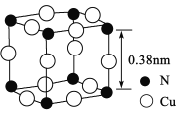
【题目】N、F、Cu及其化合物在化工、医药、材料等方面应用十分广泛。回答下列有关问题:
(1)N原子中最高能级的电子的电子云轮廓图为___________;基态Cu+的核外电子排布式为____________。
(2)化合物(CH3)3N可用于制备医药、农药。分子中N原子杂化方式为________,该物质能溶于水的原因是_____________________。
(3)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,其阳离子的空间构型为_____________,写出一种与[H2F]+互为等电子体的分子______________(写化学式)。
(4)氮、铜形成的一种化合物的晶胞结构如图所示。与每个Cu原子紧邻的Cu原子有____个,令阿伏加德罗常数的值为NA,该晶体的密度为______g/cm3。(列出计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有稀盐酸的烧杯中逐滴加入NaOH溶液,测得烧杯中溶液的pH变化如图所示,下列说法正确的是( )

A.a点所示的溶液中含有的溶质是NaOH和NaCl
B.b点所示的溶液能使紫色石蕊溶液变红
C.c点表示NaOH和稀盐酸恰好完全反应
D.a、b、c所示的溶液中都含有Na+、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为比较镁、铝的金属性强弱,设计了如下实验:
(1)向两支试管中分别加入3 mL同浓度的稀盐酸,再将两块大小相同且纯净的镁片和铝片分别加入试管中,反应初始时观察到如图所示的现象,则试管b内加入的金属为____________(写化学式)。
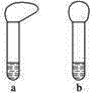
(2)若加入的两块金属的物质的量相等,且试管中稀盐酸足量,充分反应后,气球状态也如上图所示,则试管b中反应的离子方程式为___________。
(3)分析判断,实验________[填“(1)”或“(2)”]能证明镁的金属性强于铝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应4CO(g)+2NO2(g)![]() N2(g)+4CO2(g),以下化学反应速率的表示中,所表示反应速率最快的是
N2(g)+4CO2(g),以下化学反应速率的表示中,所表示反应速率最快的是
A. v(CO)=1.6 mol·(L·min) -1B. v(NO2)=0.9 mol·(L·min) -1
C. v(N2)=0.25mol·(L·min) -1D. v(CO2)=1.2 mol·(L·min) -1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性![]() ,氧化性
,氧化性![]() ,在含
,在含![]() 的溶液中逐滴加入
的溶液中逐滴加入![]() 溶液,加入
溶液,加入![]() 的物质的量和产生
的物质的量和产生![]() 的物质的量的关系曲线如图所示,下列叙述中正确的是( )
的物质的量的关系曲线如图所示,下列叙述中正确的是( )
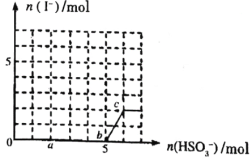
A.反应过程中溶液的![]() 先变小后变大
先变小后变大
B.![]() 点时消耗的
点时消耗的![]() 的物质的量为
的物质的量为![]()
C.![]() 间反应:
间反应:![]()
D.溶液中![]() 与
与![]() 的物质的量之比为
的物质的量之比为![]() 时,加入的
时,加入的![]() 的物质的量为
的物质的量为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com