
【题目】已知:还原性![]() ,氧化性
,氧化性![]() ,在含
,在含![]() 的溶液中逐滴加入
的溶液中逐滴加入![]() 溶液,加入
溶液,加入![]() 的物质的量和产生
的物质的量和产生![]() 的物质的量的关系曲线如图所示,下列叙述中正确的是( )
的物质的量的关系曲线如图所示,下列叙述中正确的是( )
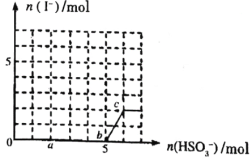
A.反应过程中溶液的![]() 先变小后变大
先变小后变大
B.![]() 点时消耗的
点时消耗的![]() 的物质的量为
的物质的量为![]()
C.![]() 间反应:
间反应:![]()
D.溶液中![]() 与
与![]() 的物质的量之比为
的物质的量之比为![]() 时,加入的
时,加入的![]() 的物质的量为
的物质的量为![]()
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种新型能源,被誉为“21世纪的清洁燃料”。
(1)用CO和H2合成二甲醚的反应为:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)△H。
CH3OCH3(g)+CO2(g)△H。
几种物质的相对能量如下:
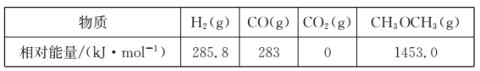
△H=______kJ·mo1。改变下列“量”,一定会引起△H发生变化的是_____(填代号)。
A.温度 B.反应物浓度 C.催化剂 D.化学计量数
(2)有利于提高反应中CH3OCH3产率的条件为_______(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(3)采用新型催化剂(主要成分是Cu—Mn的合金)制备二甲醚。催化剂中n(Mn)/n(Cu)对合成二甲醚的影响情况如下图所示。
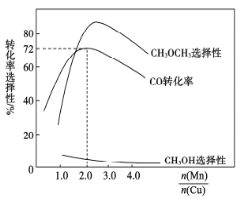
当n(Mn)/n(Cu)=2时,二甲醚的选择性(![]() )为85.8%,此时二甲醚的产率为_________。
)为85.8%,此时二甲醚的产率为_________。
(4)用二甲醚燃料电池电解法可将酸性含铬废水(主要含有Cr2O72-)转化为Cr3+。原理如下图:
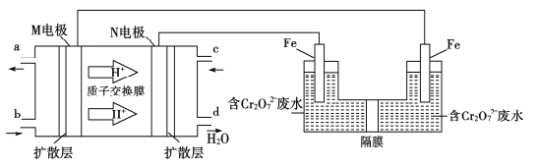
①燃料电池中的负极是______(填“M”或“N”)电极。电解池阴极的电极反应式为______________________________。
②消耗6.9g二甲醚时可处理Cr的含量为26.0g·L-1的废水1L,该套装置的能量利用率为___________。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喘通(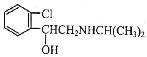 )是我国最早自主研发生产的药物之一,主要用于支气管哮喘的治疗。其合成路线如图:
)是我国最早自主研发生产的药物之一,主要用于支气管哮喘的治疗。其合成路线如图:
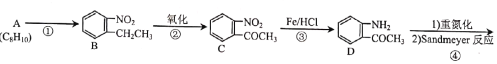
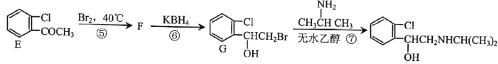
(1)A的化学名称为___,反应①的试剂与条件为__,反应③的反应类型为___。
(2)E中含氧官能团的名称为__。
(3)F的结构简式为___。
(4)反应⑦的化学方程式为__。
(5)B的同分异构体H是含有氨基、能与NaHCO3溶液反应放出气体的芳香族化合物。则H的结构有__种(不含立体异构)。其中核磁共振氢谱有5组峰,且峰面积之比为1:2:2:2:2的是__(写出其中一种的结构简式)。
(6)《神农本草经》中记载麻黄能“止咳逆上气”。从麻黄中提取的麻黄碱也可用于治疗支气管哮喘,其结构简式为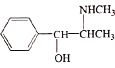 。
。
已知:![]() + CH3COCl
+ CH3COCl![]() +HCl。设计以苯、CH3CH2COCl、CH3NH2为原料合成麻黄碱的合成路线__。(无机试剂任选)
+HCl。设计以苯、CH3CH2COCl、CH3NH2为原料合成麻黄碱的合成路线__。(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电化学系统有两个研究方向。一是利用阳极室微生物降解有机废水,二是利用阴极还原能力处理含重金属废水。某文献报道,利用下图所示装置可使微生物和六价铬离子(Cr2O72—)不直接接触,处理高浓度含铬废水。装置工作时,下列说法错误的是( )
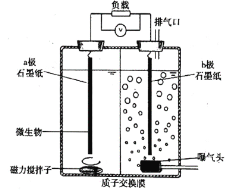
A.![]() 极附近
极附近![]() 增大
增大
B.该装置利用微生物产生电子和![]()
C.![]() 极石墨纸发生反应:
极石墨纸发生反应:![]()
D.利用该装置原理既能处理含铬废水,又能同步回收电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓![]() 为黑灰色固体,是重要的半导体材料,用砷化镓制成的半导体器件具有低温性能好、抗辐射能力强等优点。请回答下列问题:
为黑灰色固体,是重要的半导体材料,用砷化镓制成的半导体器件具有低温性能好、抗辐射能力强等优点。请回答下列问题:
(1)基态![]() 原子核外电子占据最高能级的电子云轮廓图为________形。
原子核外电子占据最高能级的电子云轮廓图为________形。
(2)砷化镓可由![]() 和
和![]() 制得。在常温常压下,
制得。在常温常压下,![]() 为无色透明液体,则
为无色透明液体,则![]() 固体属于________晶体。
固体属于________晶体。![]() 的沸点低于
的沸点低于![]() 的原因为________。
的原因为________。
(3)亚砷酸![]() 是一种三元弱酸,分子中含有羟基数目为________个;根据价层电子对互斥理论推测
是一种三元弱酸,分子中含有羟基数目为________个;根据价层电子对互斥理论推测![]() 的空间构型为________;与
的空间构型为________;与![]() 互为等电子体的一种分子为________。
互为等电子体的一种分子为________。
(4)![]() 的熔点为
的熔点为![]() ,晶胞结构如图所示:
,晶胞结构如图所示:
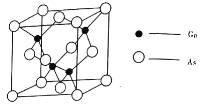
①在![]() 晶体中,镓原子的配位数是________,与同一个镓原子相连的砷原子构成的空间构型为________。
晶体中,镓原子的配位数是________,与同一个镓原子相连的砷原子构成的空间构型为________。
②若砷化镓晶胞边长为![]() 。则该晶体密度为________
。则该晶体密度为________![]() (用含
(用含![]() 的代数式表示)。
的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的能量多
B.由C(石墨)→C(金刚石);△H=+1.9kJmol-1可知,金刚石比石墨稳定
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则H2燃烧热的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
D.在稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1,若将含0.5mol H2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3KJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6.72L标况下的氯气通入到500ml一定物质的量浓度的氢氧化钠溶液中,恰好完全反应。则
①该氢氧化钠溶液的浓度是多少?②生成次氯酸钠的质量是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据如图判断,下列说法正确的是( )
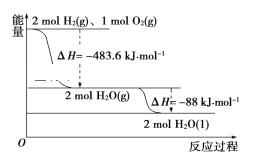
A. 氢气的燃烧热ΔH=-241.8 kJ·mol-1
B. 2 mol H2(g)与1mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低
C. 液态水分解的热化学方程式为2H2O(l)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com