
����Ŀ���黯��![]() Ϊ�ڻ�ɫ���壬����Ҫ�İ뵼����ϣ����黯���Ƴɵİ뵼���������е������ܺá�����������ǿ���ŵ㡣��ش��������⣺
Ϊ�ڻ�ɫ���壬����Ҫ�İ뵼����ϣ����黯���Ƴɵİ뵼���������е������ܺá�����������ǿ���ŵ㡣��ش��������⣺
(1)��̬![]() ԭ�Ӻ������ռ������ܼ��ĵ���������ͼΪ________�Ρ�
ԭ�Ӻ������ռ������ܼ��ĵ���������ͼΪ________�Ρ�
(2)�黯�ؿ���![]() ��
��![]() �Ƶá��ڳ��³�ѹ�£�
�Ƶá��ڳ��³�ѹ�£�![]() Ϊ��ɫ��Һ�壬��
Ϊ��ɫ��Һ�壬��![]() ��������________���塣
��������________���塣![]() �ķе����
�ķе����![]() ��ԭ��Ϊ________��
��ԭ��Ϊ________��
(3)������![]() ��һ����Ԫ���ᣬ�����к����ǻ���ĿΪ________�������ݼ۲���ӶԻ��������Ʋ�
��һ����Ԫ���ᣬ�����к����ǻ���ĿΪ________�������ݼ۲���ӶԻ��������Ʋ�![]() �Ŀռ乹��Ϊ________����
�Ŀռ乹��Ϊ________����![]() ��Ϊ�ȵ������һ�ַ���Ϊ________��
��Ϊ�ȵ������һ�ַ���Ϊ________��
(4)![]() ���۵�Ϊ
���۵�Ϊ![]() �������ṹ��ͼ��ʾ��
�������ṹ��ͼ��ʾ��
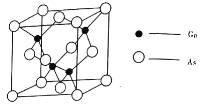
����![]() �����У���ԭ�ӵ���λ����________����ͬһ����ԭ����������ԭ�ӹ��ɵĿռ乹��Ϊ________��
�����У���ԭ�ӵ���λ����________����ͬһ����ԭ����������ԭ�ӹ��ɵĿռ乹��Ϊ________��
�����黯�ؾ����߳�Ϊ![]() ����þ����ܶ�Ϊ________
����þ����ܶ�Ϊ________![]() (�ú�
(�ú�![]() �Ĵ���ʽ��ʾ)��
�Ĵ���ʽ��ʾ)��
���𰸡�������![]() ��Ĵ���
��Ĵ���![]() ���� NH3���Ӽ������� 3 ������
���� NH3���Ӽ������� 3 ������ ![]() ��
��![]() ��
��![]() 4 ����������
4 ���������� ![]()
��������
![]() ��̬Asԭ�Ӻ������ռ������ܼ�Ϊ4p�ܼ��������������ͼΪ������
��̬Asԭ�Ӻ������ռ������ܼ�Ϊ4p�ܼ��������������ͼΪ������![]() ��Ĵ���
��Ĵ���![]() ���ʴ�Ϊ��������
���ʴ�Ϊ��������![]() ��Ĵ���
��Ĵ���![]() ��
��![]() ���³�ѹ�£�
���³�ѹ�£�![]() Ϊ��ɫ��Һ�壬����
Ϊ��ɫ��Һ�壬����![]() ���ڷ��Ӿ��壬���ڰ����Ӽ��ܹ��γ���������
���ڷ��Ӿ��壬���ڰ����Ӽ��ܹ��γ���������![]() �ķе����
�ķе����![]() ���ʴ�Ϊ�����ӣ�NH3���Ӽ���������
���ʴ�Ϊ�����ӣ�NH3���Ӽ���������![]() ����������
����������![]() ��һ����Ԫ���ᣬ�����京�е��ǻ���ĿΪ3��
��һ����Ԫ���ᣬ�����京�е��ǻ���ĿΪ3��![]() ������ԭ�ӵļ۲���Ӷ���Ϊ
������ԭ�ӵļ۲���Ӷ���Ϊ![]() ��������һ�Թµ��Ӷԣ�������ռ乹��Ϊ�����Σ����ݵȵ�����ĸ����֪��
��������һ�Թµ��Ӷԣ�������ռ乹��Ϊ�����Σ����ݵȵ�����ĸ����֪��![]() Ϊ�ȵ������һ�ַ���Ϊ
Ϊ�ȵ������һ�ַ���Ϊ![]() ��
��![]() ��
��![]() ���ʴ�Ϊ��3�������Σ�
���ʴ�Ϊ��3�������Σ�![]() ��
��![]() ��
��![]() ��
��![]() ���ݾ����ṹ������֪GaAs�����У���ԭ�ӵ���λ����4����ͬһ����ԭ����������ԭ�ӹ��ɵĿռ乹��Ϊ���������Σ��ʴ�Ϊ��4���������壻
���ݾ����ṹ������֪GaAs�����У���ԭ�ӵ���λ����4����ͬһ����ԭ����������ԭ�ӹ��ɵĿռ乹��Ϊ���������Σ��ʴ�Ϊ��4���������壻![]() �黯�ؾ����к���4����ԭ�ӣ���ԭ����ĿΪ
�黯�ؾ����к���4����ԭ�ӣ���ԭ����ĿΪ![]() �����Ծ����ܶ�Ϊ
�����Ծ����ܶ�Ϊ![]() g��cm-3���ʴ�Ϊ��
g��cm-3���ʴ�Ϊ��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʢ��ϡ������ձ�����μ���NaOH��Һ������ձ�����Һ��pH�仯��ͼ��ʾ������˵����ȷ���ǣ� ��

A.a����ʾ����Һ�к��е�������NaOH��NaCl
B.b����ʾ����Һ��ʹ��ɫʯ����Һ���
C.c���ʾNaOH��ϡ����ǡ����ȫ��Ӧ
D.a��b��c��ʾ����Һ�ж�����Na+��Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����2L������X��Y��Z������̬���ʵ����ʵ���(n)��ʱ��(t)�仯��������ͼ��ʾ����ͼ������
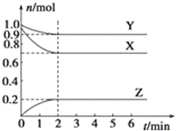
��1���÷�Ӧ�Ļ�ѧ����ʽΪ��____��
��2����Ӧ��ʼ��2min����X��ʾ��ƽ����Ӧ����Ϊ_____��
��3����Ӧ��ʼ��2minʱ��Y��ת����Ϊ___��
��4������������Ӧ���ı���������ʱ����Ӧ���ʻᷢ��ʲô�仯(���������С�� ���䡱)��
�ٽ����¶ȣ�_____��
�ڱ���������������䣬����X�����ʵ�����____��
�۱���������������䣬����He��____��
�����������������____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ1��ʾK��Cu��Si��H��C��N����Ԫ�ص��ʵ��۵�ߵͣ�����c��d�����Ⱥ͵�������壬e����Ϊ�뵼����ϡ�����˵���������( )
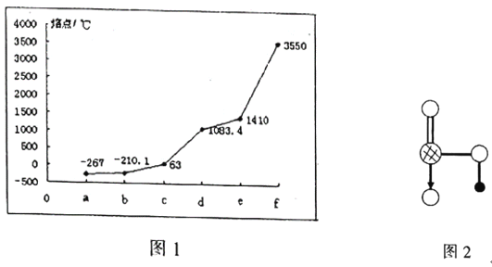
A.d����������Һ������
B.aԪ����bԪ�ؿ��γɺ����������Ϊ8�ķ���
C.ͼ2Ϊ��������Ԫ���е�һ��Ԫ���γɵĺ�����Ľṹ
D.e��������c������������Ӧˮ�������Һ������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ԭ��![]() ��������
��������![]() ���ں�
���ں�![]() ����Һ����μ���
����Һ����μ���![]() ��Һ������
��Һ������![]() �����ʵ����Ͳ���
�����ʵ����Ͳ���![]() �����ʵ����Ĺ�ϵ������ͼ��ʾ��������������ȷ����( )
�����ʵ����Ĺ�ϵ������ͼ��ʾ��������������ȷ����( )
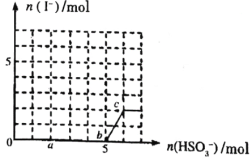
A.��Ӧ��������Һ��![]() �ȱ�С����
�ȱ�С����
B.![]() ��ʱ���ĵ�
��ʱ���ĵ�![]() �����ʵ���Ϊ
�����ʵ���Ϊ![]()
C.![]() �䷴Ӧ��
�䷴Ӧ��![]()
D.��Һ��![]() ��
��![]() �����ʵ���֮��Ϊ
�����ʵ���֮��Ϊ![]() ʱ�������
ʱ�������![]() �����ʵ���Ϊ
�����ʵ���Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��������£�����̶����ܱ������У����п��淴ӦA��s��+3B��g��![]() 3C��g�������в���˵�����淴Ӧ�ﵽƽ��״̬����
3C��g�������в���˵�����淴Ӧ�ﵽƽ��״̬����
A. B��Ũ�Ȳ��ٱ仯
B. ��������ѹǿ���ٱ仯
C. ���������ܶȲ��ٱ仯
D. ��������ƽ����Է����������ٸı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӣ�Ni-Cd���ɳ�������ִ��������й㷺Ӧ�á���֪ij���ӵ�صĵ������ҺΪKOH��Һ����䡢�ŵ簴��ʽ���У�Cd+2NiOOH +2H2O![]() Cd(OH)2 + 2Ni(OH)2�йظõ�ص�˵����ȷ����
Cd(OH)2 + 2Ni(OH)2�йظõ�ص�˵����ȷ����
A.���ʱ������Ӧ��Ni(OH)2��e��+ OH����NiOOH + H2O
B.�ŵ�ʱ����������Һ��pH����
C.�ŵ�ʱ�������Һ�е�OH���������ƶ�
D.���ʱCd�����Դ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������·�����Ӧ��2A(g)+2B(g) ![]() xC(g)+2D(g)����2L�ܱ������У���4molA��2molB��ϣ�2min��ﵽƽ��ʱ����1.6molC���ֲ�÷�Ӧ����v(D)=0.2mol��L��1��min��1������˵����ȷ����
xC(g)+2D(g)����2L�ܱ������У���4molA��2molB��ϣ�2min��ﵽƽ��ʱ����1.6molC���ֲ�÷�Ӧ����v(D)=0.2mol��L��1��min��1������˵����ȷ����
A. A��B��ת���ʾ���20% B. x = 2
C. ƽ��ʱB�����ʵ���Ϊ1.2mol D. ƽ��ʱ����ѹǿ��ԭ����С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ρ������ڹ�ũҵ�����������ˮ�����ȷ������ż���㷺��Ӧ�ã�������м�����ᷴӦ�Ʊ�����������
��֪����4Fe2����O2��4H��===4Fe3����2H2O
������������ˮ�е��ܽ������ͼ��
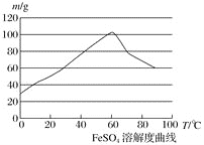
(1)���ȣ�����м����̼������Һ����г����ۣ������Һ�壬��ˮϴ����м���˲����У������Һ��ķ���ͨ�����ù��ˣ�ʹ�õIJ�����____________(��д��������)��
(2)����������м�м������������ᣬ��һ���¶���ʹ�䷴Ӧ�����ٲ������壬���ȹ��ˣ�������������Һ��
������Ũ��Ӧѡ��(����ĸ���)__________����������������������������������������
A��Ũ���� B��10 moL��L��1����
C��3 moL��L��1���� D������Ũ������
���¶��˿�����________�����ȵ�ͬʱ���ʵ�����ˮ��ԭ����___________________��
�۷�Ӧ��Ӧ����![]() _________ (���������������) 1��
_________ (���������������) 1��
(3)�������ڿ������ױ����������γɸ��ο��ȶ����ڣ��硰Ħ���Ρ�����(NH4)2SO4��FeSO4��6H2O(���������)������������������Һ�м�������ϡ������Һ���ټ��뱥���������Һ������_______��_______��_______��_______��һϵ�в��������á�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com