
【题目】亚铁盐、铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用,现用铁屑与硫酸反应制备硫酸亚铁。
已知:①4Fe2++O2+4H+===4Fe3++2H2O
②硫酸亚铁在水中的溶解度如下图:
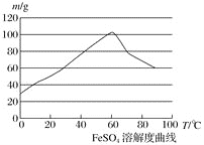
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。此步骤中,分离出液体的方法通常不用过滤,使用的操作是____________(填写操作名称)。
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得硫酸亚铁溶液。
①硫酸浓度应选择(填字母序号)__________;
A.浓硫酸 B.10 moL·L-1硫酸
C.3 moL·L-1硫酸 D.任意浓度硫酸
②温度宜控制在________,加热的同时需适当补充水,原因是___________________;
③反应中应保持![]() _________ (填“<”“>”或“=”) 1。
_________ (填“<”“>”或“=”) 1。
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在,如“摩尔盐”,即(NH4)2SO4·FeSO4·6H2O(硫酸亚铁铵),就是在硫酸亚铁溶液中加入少量稀硫酸溶液,再加入饱和硫酸铵溶液,经过_______、_______、_______、_______等一系列操作后所得。
【答案】 倾析 C 60 ℃左右 防止硫酸亚铁晶体析出 > 蒸发浓缩 冷却结晶 滤洗涤 过自然干燥
【解析】(1)由于Fe屑沉在容器的底部,溶液在上部,所以分离出液体的方法通常不用过滤,使用的操作是倾析法;(2)在室温下,Fe在浓硫酸中会发生钝化现象,在10moL/L硫酸中容易发生氧化还原反应产生硫酸铁和SO2和水;由于FeSO4在60℃左右溶解度最大,所以温度宜控制在60℃左右;为防止硫酸亚铁晶体析出,加热的同时需适当补充水,为了防止在加热的过程中Fe2+被氧化为Fe3+,Fe粉应该稍微过量一些;(3)稀硫酸的作用是为了抑制Fe2+、NH4+的水解,防止产物不纯。
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.此步骤中,由于Fe屑沉在容器的底部,溶液在上部,所以分离出液体的方法通常不用过滤,使用的操作是倾析法;(2)在室温下,Fe在浓硫酸中会发生钝化现象.在10moL/L硫酸中容易发生氧化还原反应产生硫酸铁和SO2和水,不能得到硫酸亚铁,所以要用3moL/L硫酸.由于FeSO4在60℃左右溶解度最大,所以温度宜控制在60℃左右.为防止硫酸亚铁晶体析出,加热的同时需适当补充水.为了防止在加热的过程中Fe2+被氧化为Fe3+,Fe粉应该稍微过量一些,所以反应中应保持![]() >1;(3)在制取摩尔盐如硫酸亚铁铵[(NH4)2SO4FeSO46H2O]的过程,就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得.过程中稀硫酸的作用是为了抑制Fe2+、NH4+的水解,防止产物不纯。
>1;(3)在制取摩尔盐如硫酸亚铁铵[(NH4)2SO4FeSO46H2O]的过程,就是在FeSO4溶液中加入少量稀H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后所得.过程中稀硫酸的作用是为了抑制Fe2+、NH4+的水解,防止产物不纯。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】砷化镓![]() 为黑灰色固体,是重要的半导体材料,用砷化镓制成的半导体器件具有低温性能好、抗辐射能力强等优点。请回答下列问题:
为黑灰色固体,是重要的半导体材料,用砷化镓制成的半导体器件具有低温性能好、抗辐射能力强等优点。请回答下列问题:
(1)基态![]() 原子核外电子占据最高能级的电子云轮廓图为________形。
原子核外电子占据最高能级的电子云轮廓图为________形。
(2)砷化镓可由![]() 和
和![]() 制得。在常温常压下,
制得。在常温常压下,![]() 为无色透明液体,则
为无色透明液体,则![]() 固体属于________晶体。
固体属于________晶体。![]() 的沸点低于
的沸点低于![]() 的原因为________。
的原因为________。
(3)亚砷酸![]() 是一种三元弱酸,分子中含有羟基数目为________个;根据价层电子对互斥理论推测
是一种三元弱酸,分子中含有羟基数目为________个;根据价层电子对互斥理论推测![]() 的空间构型为________;与
的空间构型为________;与![]() 互为等电子体的一种分子为________。
互为等电子体的一种分子为________。
(4)![]() 的熔点为
的熔点为![]() ,晶胞结构如图所示:
,晶胞结构如图所示:
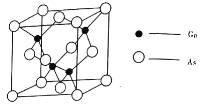
①在![]() 晶体中,镓原子的配位数是________,与同一个镓原子相连的砷原子构成的空间构型为________。
晶体中,镓原子的配位数是________,与同一个镓原子相连的砷原子构成的空间构型为________。
②若砷化镓晶胞边长为![]() 。则该晶体密度为________
。则该晶体密度为________![]() (用含
(用含![]() 的代数式表示)。
的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6.72L标况下的氯气通入到500ml一定物质的量浓度的氢氧化钠溶液中,恰好完全反应。则
①该氢氧化钠溶液的浓度是多少?②生成次氯酸钠的质量是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
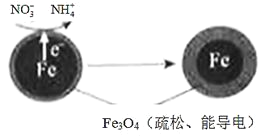
①作负极的物质是_________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是_________。
(3)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3-去除率和铁的最终物质形态不同的原因:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据如图判断,下列说法正确的是( )
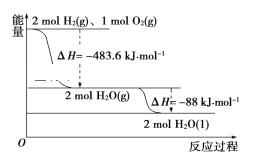
A. 氢气的燃烧热ΔH=-241.8 kJ·mol-1
B. 2 mol H2(g)与1mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低
C. 液态水分解的热化学方程式为2H2O(l)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)![]() xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol·L1·min1,下列说法正确的是
A. 反应速率v(B)=0.25 mol·L-1·min-1
B. 该反应方程式中x=1
C. 2min时,A的物质的量为1.5mol
D. 2min时,A的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.在10mL2.4mol·L-1的NaOH溶液中加入50mL水,稀释后溶液的浓度是0.4mol·L-1
B.从1L2mol·L-1的H2SO4溶液中取出0.5L,所得溶液的浓度为1mol·L-1
C.配制500mL0.5mol·L-1的CuSO4溶液,需62.5g胆矾
D.中和100g19.6%的H2SO4溶液,需要NaOH4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在学校科技节活动中表演了“滴水生火”、“吹气生火”的小魔术。如图所示,在蒸发皿上放一小团脱脂棉,在里面裹入一种淡黄色的化合物,对着脱脂棉吹气或者用胶头滴管滴几滴水,一会儿脱脂棉会燃烧起来。
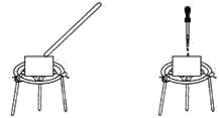
(1)淡黄色的化合物为___。
(2)由“滴水生火”的小魔术可以得出Na2O2和H2O发生反应的依据:a.有氧气生成;b.__。该反应的化学方程式是___。
(3)“吹气生火”的过程中发生的化学反应方程式为__,用双线桥标出反应中电子转移的方向和数目:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下合成路线(部分反应条件已省略),下列有关说法错误的是

A.物质A的名称为乙炔,其电子式为![]()
B.物质B中所有原子可能共平面
C.物质C的同分异构体中含有苯环且苯环上有两个取代基的有3种
D.反应③的反应条件为O2、Cu加热,反应类型为氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com