
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
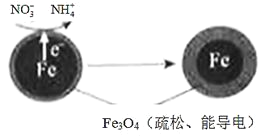
①作负极的物质是_________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是_________。
(3)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3-去除率和铁的最终物质形态不同的原因:_________。
【答案】铁 NO3-+8e-+10H+= NH4++3H2O 因为铁表面生成不导电的FeO(OH),阻止反应进一步发生 Fe+2H+=Fe2++H2↑,初始pH较小,氢离子浓度高,产生的Fe2+浓度大,促使FeO(OH)转化为可导电的Fe3O4,使反应进行的更完全,初始pH高时,产生的Fe2+浓度小,从而造成NO3-去除率和铁的最终物质形态不同
【解析】
(1)①Fe还原水体中NO3-,根据题意Fe3O4为电解质,Fe作还原剂,失去电子,发生氧化反应,作原电池的负极;
②NO3-在正极得电子发生还原反应产生NH4+,根据电荷守恒及原子守恒书写电极反应式;
(2)由于Fe3O4为电解质,而电解质主要作用是为电子转移提供媒介,然后根据FeO(OH)不导电进行分析;
(3)根据Fe2+的作用进行分析。
(1)①Fe是活泼的金属,根据还原水体中的NO3-的反应原理图可知,Fe失去电子被氧化,作原电池的负极;
②正极上NO3-得到电子发生还原反应变为NH4+,结合元素和电荷守恒可知电极反应式为:NO3-+8e-+10H+=NH4++3H2O;
(2)从pH对硝酸根去除率的影响来看,初始pH=4.5时去除率低,主要是因为铁表面产生了不导电的FeO(OH),阻止反应进一步发生;
(3)Fe+2H+=Fe2++H2↑,初始时溶液的pH较小,溶液中氢离子浓度高,产生的Fe2+浓度较大,促使FeO(OH)转化为可导电的Fe3O4,因而使NO3-去除反应进行的更完全;当初始pH高时,由于产生的Fe2+浓度小,从而造成NO3-去除率和铁的最终物质形态不同,因而NO3-去除率降低。


科目:高中化学 来源: 题型:
【题目】图1表示K、Cu、Si、H、C、N六种元素单质的熔点高低,其中c、d均是热和电的良导体,e常作为半导体材料。下列说法错误的是( )
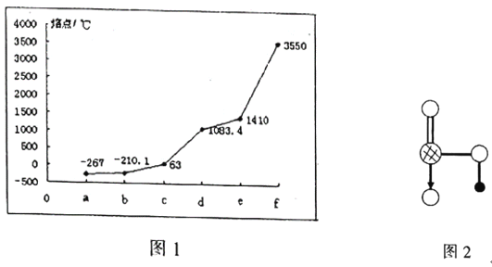
A.d的硫酸盐溶液呈酸性
B.a元素与b元素可形成核外电子总数为8的分子
C.图2为上述六种元素中的一种元素形成的含氧酸的结构
D.e单质能与c的最高价氧化物对应水化物的溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生反应:2A(g)+2B(g) ![]() xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.6molC,又测得反应速率v(D)=0.2mol·L-1·min-1,下列说法正确的是
xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.6molC,又测得反应速率v(D)=0.2mol·L-1·min-1,下列说法正确的是
A. A和B的转化率均是20% B. x = 2
C. 平衡时B的物质的量为1.2mol D. 平衡时气体压强比原来减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,填写有关现象及化学方程式。
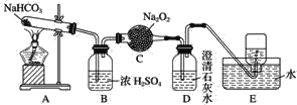
(1)A中现象是________________________________。
(2)B中浓硫酸的作用是__________________________。
(3)C中发生反应的化学方程式为____________________________________。
(4)D中的现象是______________________________。
(5)E中收集的气体是____________(填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(1)参加反应的HNO3和作为氧化剂的HNO3的个数比为________。
(2)若有64 g Cu被氧化,则被还原的HNO3的质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。
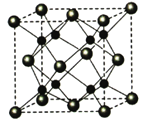
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁盐、铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用,现用铁屑与硫酸反应制备硫酸亚铁。
已知:①4Fe2++O2+4H+===4Fe3++2H2O
②硫酸亚铁在水中的溶解度如下图:
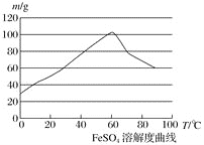
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。此步骤中,分离出液体的方法通常不用过滤,使用的操作是____________(填写操作名称)。
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得硫酸亚铁溶液。
①硫酸浓度应选择(填字母序号)__________;
A.浓硫酸 B.10 moL·L-1硫酸
C.3 moL·L-1硫酸 D.任意浓度硫酸
②温度宜控制在________,加热的同时需适当补充水,原因是___________________;
③反应中应保持![]() _________ (填“<”“>”或“=”) 1。
_________ (填“<”“>”或“=”) 1。
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在,如“摩尔盐”,即(NH4)2SO4·FeSO4·6H2O(硫酸亚铁铵),就是在硫酸亚铁溶液中加入少量稀硫酸溶液,再加入饱和硫酸铵溶液,经过_______、_______、_______、_______等一系列操作后所得。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德裔美籍固体物理学家古迪纳夫在研究钴酸锂LiCOO3)。磷酸亚铁锂(LiFePO4)等正极材料及锂离子电池领域作出卓著贡献而获得2019年诺贝尔化学奖,其中磷酸亚铁锂(LiFePO4)是一种新型汽车理离子电池,总反应为FePO4+Li![]() LiFePO4,电池中的固体电解质可传导离子,下列说法错误的是( )
LiFePO4,电池中的固体电解质可传导离子,下列说法错误的是( )
A.充电时,铁元素发生还原反应
B.放电时,Li作负极
C.放电时,正极反应为FePO4+Li++e-=LiFePO4
D.若用该电池电解饱和食盐水(电解池电极均为情性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为1.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
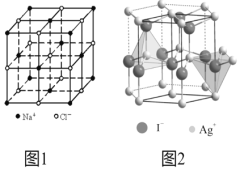
【题目】早在1913年就有报道说,在400℃以上AgI晶体的导电能力是室温时的上万倍,可与电解质溶液相比。
(1)已知Ag元素的原子序数为47,则Ag元素在周期表中的位置是_____________,属于_____区,基态Ag原子的价电子排布式为__________。
(2)硫代硫酸银(Ag2S2O3)是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠(Na2S2O3)溶液生成[Ag(S2O3)2]3-等络阴离子。在[Ag(S2O3)2]3-中配位原子是______(填名称),配体阴离子的空间构型是______,中心原子采用_____杂化。
(3)碘的最高价氧化物的水化物有HIO4(偏高碘酸,不稳定)和H5IO6(正高碘酸)等多种形式,它们的酸性HIO4_____ H5IO6(填:弱于、等于或强于)。氯、溴、碘的氢化物的酸性由强到弱排序为______(用化学式表示),其结构原因是______。
(4)在离子晶体中,当0.414<r(阳离子):r(阴离子)<0.732时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知r(Ag+):r(I-)=0.573,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为______,造成AgI晶体结构不同于NaCl晶体结构的原因不可能是_______。
a. 几何因素 b. 电荷因素 c. 键性因素
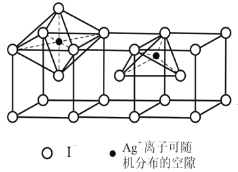
(5)当温度处于146~555℃间时,六方碘化银转化为α–AgI(如下图),Ag+可随机地分布在四面体空隙和八面体空隙中,多面体空隙间又彼此共面相连。因此可以想象,在电场作用下,Ag+可从一个空隙穿越到另一个空隙,沿着电场方向运动,这就不难理解α–AgI晶体是一个优良的离子导体了。则在α–AgI晶体中,n(Ag+)﹕n(八面体空隙)﹕n(四面体空隙)= ______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com