
【题目】下列说法中正确的是( )
A.在10mL2.4mol·L-1的NaOH溶液中加入50mL水,稀释后溶液的浓度是0.4mol·L-1
B.从1L2mol·L-1的H2SO4溶液中取出0.5L,所得溶液的浓度为1mol·L-1
C.配制500mL0.5mol·L-1的CuSO4溶液,需62.5g胆矾
D.中和100g19.6%的H2SO4溶液,需要NaOH4g
【答案】C
【解析】
A、稀释后体积不等于溶液和水的体积之和,无法得出溶液的体积,即无法求出物质的量浓度,故A错误;
B、溶液均一、稳定,取出0.5 L的溶液,浓度仍为2 mol·L-1,故B错误;
C、因为500 mL 0.5 mol·L-1的CuSO4溶液中,CuSO4的物质的量为0.5 L×0.5 mol·L-1=0.25 mol,胆矾的物质的量也应为0.25 mol,即质量为0.25 mol×250 g·mol-1=62.5 g,故C正确;
D、因为H2SO4的质量为100 g×19.6%=19.6 g,其物质的量为![]() =0.2 mol,中和0.2 mol H2SO4需NaOH应为0.4 mol,即0.4 mol×40 g·mol-1=16 g,故D错误;
=0.2 mol,中和0.2 mol H2SO4需NaOH应为0.4 mol,即0.4 mol×40 g·mol-1=16 g,故D错误;
答案为C。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH +2H2O![]() Cd(OH)2 + 2Ni(OH)2有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2-e-+ OH-=NiOOH + H2O
B.放电时负极附近溶液的pH不变
C.放电时电解质溶液中的OH-向正极移动
D.充电时Cd与外电源的正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(1)参加反应的HNO3和作为氧化剂的HNO3的个数比为________。
(2)若有64 g Cu被氧化,则被还原的HNO3的质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁盐、铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用,现用铁屑与硫酸反应制备硫酸亚铁。
已知:①4Fe2++O2+4H+===4Fe3++2H2O
②硫酸亚铁在水中的溶解度如下图:
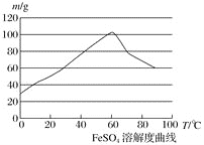
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。此步骤中,分离出液体的方法通常不用过滤,使用的操作是____________(填写操作名称)。
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得硫酸亚铁溶液。
①硫酸浓度应选择(填字母序号)__________;
A.浓硫酸 B.10 moL·L-1硫酸
C.3 moL·L-1硫酸 D.任意浓度硫酸
②温度宜控制在________,加热的同时需适当补充水,原因是___________________;
③反应中应保持![]() _________ (填“<”“>”或“=”) 1。
_________ (填“<”“>”或“=”) 1。
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在,如“摩尔盐”,即(NH4)2SO4·FeSO4·6H2O(硫酸亚铁铵),就是在硫酸亚铁溶液中加入少量稀硫酸溶液,再加入饱和硫酸铵溶液,经过_______、_______、_______、_______等一系列操作后所得。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,下列说法正确的是
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)=
Ba(OH)2(aq)=![]() BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德裔美籍固体物理学家古迪纳夫在研究钴酸锂LiCOO3)。磷酸亚铁锂(LiFePO4)等正极材料及锂离子电池领域作出卓著贡献而获得2019年诺贝尔化学奖,其中磷酸亚铁锂(LiFePO4)是一种新型汽车理离子电池,总反应为FePO4+Li![]() LiFePO4,电池中的固体电解质可传导离子,下列说法错误的是( )
LiFePO4,电池中的固体电解质可传导离子,下列说法错误的是( )
A.充电时,铁元素发生还原反应
B.放电时,Li作负极
C.放电时,正极反应为FePO4+Li++e-=LiFePO4
D.若用该电池电解饱和食盐水(电解池电极均为情性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为1.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+I2(g)![]() 2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
起始物质的量 | n(H2)/mol | n(I2)/mol | n(HI)/mol |
甲 | 0.02 | 0.02 | 0 |
乙 | 0.04 | 0.04 | 0 |
A. 平衡时,乙中H2的转化率是甲中的2倍
B. 平衡时,甲中混合物的颜色比乙中深
C. 平衡时,甲、乙中热量的变化值相等
D. 该温度下,反应的平衡常数K=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:2X(g)+Y(g)![]() 2Z(g)在不同温度和压强下的产物Z的物质的量和反应时间t的关系如图所示,下列判断正确的是( )
2Z(g)在不同温度和压强下的产物Z的物质的量和反应时间t的关系如图所示,下列判断正确的是( )

A.P1>P2 T1>T2 ΔH<0
B.P1>P2 T1<T2 ΔH<0
C.P1<P2 T1>T2 ΔH>0
D.P1<P2 T1<T2 ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:CO(g) +3H2 (g) ![]() .CH4 (g)+H2O(g)。起始以物质的量之比为1:1充人反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为)。下列有关说法正确的 是( )
.CH4 (g)+H2O(g)。起始以物质的量之比为1:1充人反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为)。下列有关说法正确的 是( )

A.上述反应的△H<0
B.N点时的反应速率一定比M点快
C.降低温度,H2的转化率可达到100%
D.工业用此法制取甲烷应采用更高的压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com