
某温度下,向一定体积0.1 mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示,则( )

A.M点所示溶液的导电能力强于Q点
B.N点所示溶液中c(CH3COO-)>c(Na+)
C.M点和N点所示溶液中水的电离程度相同
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
设阿伏加德罗常数为NA,下列叙述正确的是
A.2.24 L CO2中含有的原子数为0.3NA
B.0.1 mol F- 中含有的电子数等于0.9NA
C.5.6 g铁粉与氯气反应失去的电子数为0.2NA
D.电解饱和食盐水若产生2 g氢气,则转移的电子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
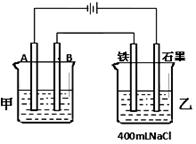
如图为相互串联的甲、乙两电解池。试回答:
(1)若甲电解池利用电解原理在铁上镀铜,
则A是 、 (填电极材料和电极名称),电极反应是 ;
B是(要求同A) 、 ,电极反应是 ,应选用的电解质溶液是 ;乙电解池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈 色。
(2)若甲电解池阴极增重1.28g,乙电解池中剩余溶液仍为400mL,则电解后所得溶液中新生成溶质的物质的量浓度为 mol/L,溶液的pH等于 。
(3)若甲电解池以I=0.21A的电流电解60min后阴极增重0.25g,则此实验测得的阿伏加德罗常数NA为多少(已知电子电量e—=1.60×10—19C)?(简要写计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H2CO3的电离常数:K1=4.4×10-7,K2=4.7×10-11,HClO的电离常数:2.95×10-8。反应:Cl2+H2O HCl+HClO达到平衡后,要使HClO浓度增大可加入( )
HCl+HClO达到平衡后,要使HClO浓度增大可加入( )
A.NaOH B.HCl C.CaCO3(固体) D.H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中微粒的物质的量浓度关系正确的是
A.Ca(ClO)2溶液中:c(Ca2+)>c(ClO-)>c(OH-)>c(H+)
B.等体积、等物质的量浓度的NaX和弱酸HX混合:c(Na+)=c(X-)>c(OH-)=c(H+)
C.常温下,将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:
c(Cl-)>c(NH4+)> c(NH3·H2O)>c(OH-)>c(H+)
D.将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:
c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,若体积为Va、pH=a的某一元强酸与体积为Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,请填写下列空白;
(1)a值可否等于3(填“可”或“否”)_________,其理由是___________________
(2)a值可否等于5(填“可”或“否”)________,其理由是____________________
(3)a的取值范围是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A. 水玻璃中通入二氧化碳:Na2SiO3+ CO2 + H2O = H2SiO3 + CO32-+2Na+
B.向氯化亚铁溶液中通入少量氯气:Fe2+ + Cl2 = Fe3+ + 2Cl-
C.硫酸厂的废气SO2用强碱溶液吸收: SO2+ 2OH-== SO42-+ H2O
D.SiO2溶于NaOH溶液:SiO2+2OH- = SiO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学兴趣小组用浓盐酸与二氧化锰加热反应来制取并收集氯气,装置图如下:

(1)写出该反应的离子方程式: 。上述反应中,氧化剂是 ,若有1 mol 氧化剂参加反应,则转移电子的物质的量是 mol 。
(2)检验该装置气密性的方法是
。
(3)请画出装置B中集气瓶内导管部分。
(4)该兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为合理的是 (填序号)。
A、氢氧化钠溶液 B、碳酸钠稀溶液
C、浓硫酸 D、饱和食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
H2O2在工业、农业、医药上都有广泛的用途。
(1)H2O2是二元弱酸,写出第一步的电离方程式 ,第二步的电离平衡常数表达式Ka2= 。
(2)许多物质都可以做H2O2分解的催化剂。一种观点认为:在反应过程中催化剂先被H2O2氧化(或还原),后又被H2O2还原(或氧化)。下列物质都可做H2O2分解的催化剂,在反应过程中先被氧化,后被还原的是 。
①I- ②Fe3+ ③Cu2+ ④Fe2+
(3)用碱性氢氧燃料电池合成H2O2,具有效率高,无污染等特点。电池总反应为:
H2 + O2 + OH- = H2O + HO2-。写出正极反应式: 。
(4)H2O2是一种环境友好的强氧化剂。电镀废水(主要含Cu2+、Ni2+,还含少量Fe3+、Fe2+、Cr3+ 等)制备硫酸镍的一种流程如下:

①第(ⅰ)步,加入H2O2反应的离子方程式 。
②第(ⅱ)步,滤渣中的主要成分在医疗上的用途是 。
③为测定NiSO4·n H2O的组成,进行如下实验:称取2.627g样品,配制成250.00 mL溶液。准确量取配制的溶液25.00 mL,用0.04000 mol·L-1的EDTA(Na2H2Y)标准溶液滴定Ni2+(离子方程式为Ni2++ H2Y2-=NiY2-+ 2H+),消耗EDTA标准溶液25.00 mL。则硫酸镍晶体的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com