


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、CuCl2=Cu+Cl2↑ |
| B、Na2CO3=2Na++CO32- |
| C、H2SO4=2H++S6++4O2- |
| D、Ba(OH)2=Ba+2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 |
| Cr | 653 | 1592 | 2987 |
| Q | 759 | 1561 | 2957 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某无色溶液中:Na+、Cu2+、Cl-、MnO4- |
| B、含有大量Fe3+的溶液中:Na+、SO42-、K+、SCN- |
| C、含有大量NH4+的溶液中:Ba2+、K+、Cl-、OH- |
| D、在pH=1的溶液中:K+、Fe3+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强电解质溶液的导电性不一定强于弱电解质溶液的导电性 |
| B、电解质溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数 |
| C、易溶物是强电解质,难溶物一定是弱电解质 |
| D、硫酸钡在水里的溶解度很小,但溶于水的硫酸钡全部电离,所以硫酸钡是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热煮沸MgCO3悬浊液,最终得到Mg(OH)2沉淀,说明Ksp(MgCO3)<Ksp[Mg(OH)2] |
| B、胆矾晶体投入浓硫酸中变成白色固体是化学变化 |
| C、电解AlCl3水溶液,阴极周围出现白色胶状沉淀,说明Al(OH)3胶体粒子带正电荷 |
| D、气体甲通入溶液乙,溶液乙颜色褪去,说明气体甲一定有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | 相关信息 |
| W | W的基态原子核外3个能级上有电子,且每个能级上的电子数相等. |
| X | X原子核外L层电子数为奇数 |
| Y | Y是地壳中含量最多的元素 |
| Z | Z在同周期元素的简单离子中半径最小 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、此条件下,可认为NO分解产生O2的反应完全 |
| B、此条件下,2H2O(g)=2H2 (g)+O2(g),此时平衡常数的数值约为5×10-10 |
| C、此条件下,NO、H2O、CO2三种物质分解放出O2的倾向由大到小的顺序为H2O>NO>CO2 |
| D、以上说法都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 500℃ |
| 催化剂 |
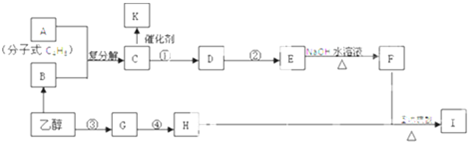
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com