
【题目】高三一年的化学复习,学生要抓住两方面,一方面是教材,另一方面是历年的高考真题。每年的高考题,在教材中几乎都能找到影子,所以同学一定要紧紧抓住教材,根据《必修一》第三章和第四章的内容回答下列问题:
(1)实验3-1是取用钠单质的实验,用品有小刀, 、 、培养皿。
(2)金属铝及其化合物在日常的生产生活中,用途很广泛,氧化铝的用途 (举一例)。 氢氧化铝的用途 (举一例)。
(3)印刷铜箔电路板常用FeCl3溶液作为腐蚀液,写出反应的离子方程式 。
(4)漂白粉或漂粉精失效的原理为(请用化学方程式表示): 、 。
(5)石灰法是目前应用最广泛的工业废气脱硫法,过程如下:通过煅烧石灰石得到生石灰,以生石灰为脱硫剂,在吸收塔中与废气中的SO2反应而将硫固定,其产物可用作建筑材料。有关的反应化学方程式为:CaCO3![]() CaO + CO2 、 。
CaO + CO2 、 。
【答案】(1)镊子;滤纸
(2)冶炼金属铝;胃酸中和剂
(3)2Fe3+ + Cu =2Fe2+ + Cu2+
(4)Ca(ClO)2 + CO2 + H2O =CaCO3 + 2HClO;2HClO=2HCl + O2
(5)SO2 + CaO ![]() CaSO3 ;2CaSO3 + O2
CaSO3 ;2CaSO3 + O2![]() 2CaSO4
2CaSO4
【解析】
试题分析:(1)实验3-1是取用钠单质的实验,用镊子将金属钠从试剂瓶中取出,用滤纸将其表面的煤油吸干,在玻璃片上用小刀切一小块钠,剩余的钠再放回原试剂瓶。所以。所需仪器:镊子、滤纸、玻璃片(或培养皿)、小刀。
故答案为:镊子、滤纸;
(2)金属铝及其化合物在日常的生产生活中,用途很广泛,氧化铝的主要用途是冶炼金属铝;氢氧化铝的用途是胃酸中和剂。
故答案为:冶炼金属铝;胃酸中和剂;
(3)印刷铜箔电路板常用FeCl3溶液作为腐蚀液,该反应的离子方程式为:2Fe3+ + Cu =2Fe2+ + Cu2+。
故答案为:2Fe3+ + Cu =2Fe2+ + Cu2+;
(4)漂白粉与空气中二氧化碳反应生成次氯酸,次氯酸很容易发生分解反应,造成漂白粉失效,漂粉精失效的原理为用化学方程式可表示为:Ca(ClO)2+CO2+H2O=CaCO3+2HClO;2HClO=2HCl+O2↑。
故答案为:Ca(ClO)2+CO2+H2O=CaCO3+2HClO;2HClO=2HCl+O2↑。
(5)煅烧石灰石得到生石灰,以生石灰为脱硫剂,在吸收塔中与废气中的SO2反应而将硫固定,其产物可用作建筑材料。有关的反应化学方程式为:CaCO3![]() CaO + CO2、SO2+CaO
CaO + CO2、SO2+CaO![]() CaSO3 ;2CaSO3+O2
CaSO3 ;2CaSO3+O2![]() 2CaSO4。
2CaSO4。
故答案为:SO2+CaO![]() CaSO3 ;2CaSO3+O2
CaSO3 ;2CaSO3+O2![]() 2CaSO4。
2CaSO4。


科目:高中化学 来源: 题型:
【题目】下列有关同分异构体的叙述正确的是
A.CH3CH2CH=CHCH2CH3不存在顺反异构体。
B.分子式为C5H10O2的羧酸有8种
C. 的属于芳香族化合物的同分异构体中不与金属钠反应的有5种
的属于芳香族化合物的同分异构体中不与金属钠反应的有5种
D.棱晶烷![]() 为正三棱柱形,它的二氯代物有5种
为正三棱柱形,它的二氯代物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列有关说法正确的是( )
A.H3PO2溶于水的电离方程式为:H3PO2![]() H++H2PO2-
H++H2PO2-
B.H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O
C.将H3PO2溶液加入到酸性高锰酸钾溶液中,H3PO2的还原产物为H3PO4
D.用惰性电极电解NaH2PO2溶液,其阳极反应式为:2H2O-4e-=O2↑+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格:
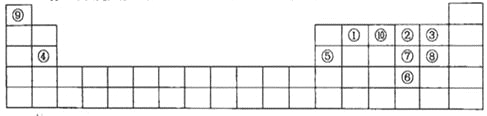
(1)在这10种元素中,非金属性最强的是___________(填序号);
(2)元素②⑧⑨以原子个数比1:1:1形成的化合物的结构式为_________,元素②与⑨形成的18e-化合物的电子式____________________;
(3)②、⑨、⑩三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M中含有的化学键类型有___________________________;
(4)比较元素⑦⑧形成的气态氢化物的稳定性:____>____(用化学式表示)。
(5)元素⑤的氧化物与氢氧化钠溶液反应的离子方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只用一种试剂就可以鉴别乙酸、乙酸乙酯、葡萄糖溶液和蔗糖溶液,这种试剂是( )
A. NaOH溶液 B. 石蕊试液 C. Cu(OH)2悬浊液 D. Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D是原子序数依次减小的四种短周期元素,C的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;A原子有2个未成对电子;A、C、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体.E是第四周期元素,其原子核外最外层电子数与D原子相同,其余各层电子均充满。
请回答下列问题(用元素符号或化学式表示):
(1)元素B、C、A的基态原子的第一电离能由大到小的顺序为__________________;
(2)M分子中C原子轨道的杂化类型为__________________;
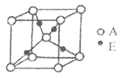
(3)E+的核外电子排布式为__________________1s22s22p63s23p63d10
,下图是由D、E形成的某种化合物的晶胞结构示意图,该化合物的化学式为__________________;
(4)化合物BD3的沸点比化合物CA4的高,其主要原因是__________________;
(5)写出与CA2互为等电子体的B3-的结构式 __________________;
(6)将CrCl3·6H2O溶解在适量水中得到深绿色溶液,溶液中Cr3+以[Cr(H2O)5Cl]2+形式存在。上述溶液中,不存在的微粒间作用力是__________________(填标号)。
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCN超标的电镀废水可用两段氧化法处理:
(1)NaCN与NaClO反应,生成NaOCN和NaCl
(2)NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同。
完成下列填空:
(1)第一次氧化时,溶液的pH应调节为____________(选填“酸性”、“碱性”或“中性”);原因是______________________。
(2)写出第二次氧化时发生反应的离子方程式。
_______________________________________
(3)处理100 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO___g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5 mg/L,达到排放标准。
(4)(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成_________、__________和H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4gNaOH和1.06g![]() 混合并配成溶液,向溶液中滴加0.1mol·
混合并配成溶液,向溶液中滴加0.1mol·![]() 稀盐酸。下列图像能正确表示加入盐酸的体积和生成
稀盐酸。下列图像能正确表示加入盐酸的体积和生成![]() 的物质的量的关系的是( )
的物质的量的关系的是( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com