
| A、Fe3O4既可看做是氧化物,又可看做是铁盐 |
| B、反应②配平后,H2O的化学计量数为3 |
| C、反应③中,Na2Fe2O4是氧化剂,Na2FeO2是还原剂 |
| D、碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强 |


 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
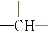 和一个-OH,则它们的可能结构有( )
和一个-OH,则它们的可能结构有( )| A、5种 | B、3种 | C、2种 | D、4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、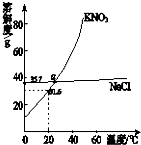 固体KNO3中混有NaCl,可用重结晶进行提纯 |
B、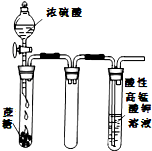 酸性KMnO4溶液中没有气泡出现,但溶液颜色会逐渐变浅乃至褪去 |
C、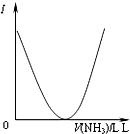 可表示乙酸溶液中通入氨气至过量过程中溶液导电性(I )的变化 |
D、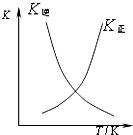 可表示在恒容密闭容器中反应“2SO2(g)+O2(g)═2SO3(g)△H<0”的平衡常数K正、K逆随温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、每生成1mol Na2ZnO2转移4mol电子 |
| B、负极反应式为:Zn+4OH--2e-=ZnO22-+2 H2O |
| C、电池工作时,溶液中的Na+向负级移动 |
| D、碱性或酸性电解液中,该电池正极反应式相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
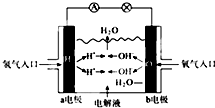
| A、a电极是负极 |
| B、b电极的电极反应为O2+4e-+2H2O=4OH- |
| C、工作时,溶液中阴离子向正极移动,阳离子向负极移动 |
| D、此电池能将化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若8>m>3,则X必定为主族元素 |
| B、若Y的气态氢化物化学式为YHn,且b=4,则该氢化物为非极性分子 |
| C、若a<b<m=n=4,则晶体类型相同时,其单质熔点:Y>X |
| D、若a=b=3,8>m>n>b,则元素非金属性:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏时,通入冷凝管的水从其上口流进,下口流出 |
| B、一束平行光照射CuSO4溶液时,从侧面可看到光亮的通路 |
| C、电解质溶液导电的原因是因为有自由移动的离子 |
| D、将饱和的FeCl3溶液滴入沸腾的NaOH溶液中可制得氢氧化铁胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L氯仿中含有的C-Cl键的数目为1.5NA |
| B、标准状况下,30g NO和16g O2混合所生成的气体分子数为NA |
| C、某温度时,1L pH=6的纯水中含有1.0×10-6NA个H+ |
| D、28g铁粉与足量Cl2反应时转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com