
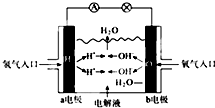
| A、a电极是负极 |
| B、b电极的电极反应为O2+4e-+2H2O=4OH- |
| C、工作时,溶液中阴离子向正极移动,阳离子向负极移动 |
| D、此电池能将化学能转化为电能 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、锌跟稀硫酸反应制取氢气,加入少量的硫酸铜能加快反应速率 |
| B、镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀 |
| C、为保护海轮的船壳,常在船壳外面镶上锌块 |
| D、钢铁在发生析氢腐蚀和吸氧腐蚀时,负极反应是相同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3O4既可看做是氧化物,又可看做是铁盐 |
| B、反应②配平后,H2O的化学计量数为3 |
| C、反应③中,Na2Fe2O4是氧化剂,Na2FeO2是还原剂 |
| D、碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解NaCl溶液时,阴极产生1 mol Cl2的同时阳极产生l molH2 |
| B、0.1 mol?L-1AlCl3溶液中Al3+的浓度为0.1 mol?L-1 |
| C、7 g 14C中所含中子数为4 NA(设NA为阿伏加德罗常数的值) |
| D、2.24 L氯气与足量NaOH稀溶液反应,转移0.1 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
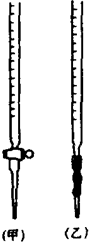 某化学兴趣小组为了测定草酸浓度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小并验证离子反应的本质,设计了如下实验.化学反应如下:KMnO4+H2C2O4+H2SO4-K2SO4+MnSO4+CO2↑+H2O 实验主要步骤如下:Ⅰ.用0.1000mol?L-1酸性高锰酸钾溶液滴定未知浓度的H2C2O4溶液Ⅱ.测定化学反应速率.Ⅲ.验证紫红色是MnO4-离子.请回答:
某化学兴趣小组为了测定草酸浓度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小并验证离子反应的本质,设计了如下实验.化学反应如下:KMnO4+H2C2O4+H2SO4-K2SO4+MnSO4+CO2↑+H2O 实验主要步骤如下:Ⅰ.用0.1000mol?L-1酸性高锰酸钾溶液滴定未知浓度的H2C2O4溶液Ⅱ.测定化学反应速率.Ⅲ.验证紫红色是MnO4-离子.请回答:| 滴定次数 | H2C2O4体积 | 滴定前KMnO4体积 | 终点时KMnO4体积 |
| 1 | 25.00mL | 0.00mL | 21.40mL |
| 2 | 25.00mL | 0.02mL | 21.44mL |
| 3 | 25.00mL | 0.04mL | 22.46mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com