
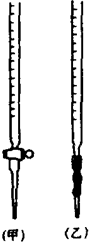
 某化学兴趣小组为了测定草酸浓度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小并验证离子反应的本质,设计了如下实验.化学反应如下:KMnO4+H2C2O4+H2SO4-K2SO4+MnSO4+CO2↑+H2O 实验主要步骤如下:Ⅰ.用0.1000mol?L-1酸性高锰酸钾溶液滴定未知浓度的H2C2O4溶液Ⅱ.测定化学反应速率.Ⅲ.验证紫红色是MnO4-离子.请回答:
某化学兴趣小组为了测定草酸浓度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小并验证离子反应的本质,设计了如下实验.化学反应如下:KMnO4+H2C2O4+H2SO4-K2SO4+MnSO4+CO2↑+H2O 实验主要步骤如下:Ⅰ.用0.1000mol?L-1酸性高锰酸钾溶液滴定未知浓度的H2C2O4溶液Ⅱ.测定化学反应速率.Ⅲ.验证紫红色是MnO4-离子.请回答:| 滴定次数 | H2C2O4体积 | 滴定前KMnO4体积 | 终点时KMnO4体积 |
| 1 | 25.00mL | 0.00mL | 21.40mL |
| 2 | 25.00mL | 0.02mL | 21.44mL |
| 3 | 25.00mL | 0.04mL | 22.46mL |
| 2 |
| 5 |
| 5 |
| 2 |
| V(KMnO4)?c(KMnO4) |
| V(H2C2O4) |
| △c |
| △t |
| 2 |
| 5 |
| 5 |
| 2 |
| V(KMnO4)?c(KMnO4) |
| V(H2C2O4) |
| 0.1mol/L×2mL |
| 2mL+2mL |
| 0.05mol/L |
| 10s |


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源: 题型:
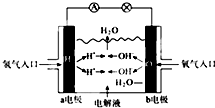
| A、a电极是负极 |
| B、b电极的电极反应为O2+4e-+2H2O=4OH- |
| C、工作时,溶液中阴离子向正极移动,阳离子向负极移动 |
| D、此电池能将化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 溶液开始变蓝时间(min) | ||||
| 0.1 mol?L-1 KI溶液 | H2O | 0.01mol?L-1 X 溶液 | 0.1 mol?L-1 双氧水 | 1 mol?L-1 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始VA=VB=a L,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2N(g)+W(g),△H>0达到平衡时,v(A)=1.2aL,则下列说法错误的是( )
如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始VA=VB=a L,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2N(g)+W(g),△H>0达到平衡时,v(A)=1.2aL,则下列说法错误的是( )| A、反应开始时,B容器中化学反应速率快 |
| B、A容器中X的转化率为40%,且比B中X的转化率小 |
| C、打开K一段时间,达到新平衡时,A的体积为2.6aL(两边通管中气体体积不计) |
| D、打开K达新平衡后,升高B容器温度,A容器体积会增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com