
| 3.2 |
| y |
| 1.2 |
| 0.6 |


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
查看答案和解析>>
科目:高中化学 来源: 题型:
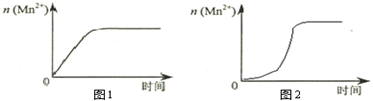
 某化学兴趣小组为了测定草酸浓度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小并验证离子反应的本质,设计了如下实验.化学反应如下:KMnO4+H2C2O4+H2SO4-K2SO4+MnSO4+CO2↑+H2O 实验主要步骤如下:Ⅰ.用0.1000mol?L-1酸性高锰酸钾溶液滴定未知浓度的H2C2O4溶液Ⅱ.测定化学反应速率.Ⅲ.验证紫红色是MnO4-离子.请回答:
某化学兴趣小组为了测定草酸浓度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小并验证离子反应的本质,设计了如下实验.化学反应如下:KMnO4+H2C2O4+H2SO4-K2SO4+MnSO4+CO2↑+H2O 实验主要步骤如下:Ⅰ.用0.1000mol?L-1酸性高锰酸钾溶液滴定未知浓度的H2C2O4溶液Ⅱ.测定化学反应速率.Ⅲ.验证紫红色是MnO4-离子.请回答:| 滴定次数 | H2C2O4体积 | 滴定前KMnO4体积 | 终点时KMnO4体积 |
| 1 | 25.00mL | 0.00mL | 21.40mL |
| 2 | 25.00mL | 0.02mL | 21.44mL |
| 3 | 25.00mL | 0.04mL | 22.46mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
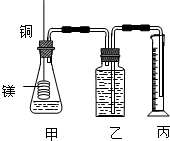 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积设计的简易实验装置图.该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积设计的简易实验装置图.该实验的主要操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com