
科目:高中化学 来源: 题型:
| A、蒸馏时,通入冷凝管的水从其上口流进,下口流出 |
| B、一束平行光照射CuSO4溶液时,从侧面可看到光亮的通路 |
| C、电解质溶液导电的原因是因为有自由移动的离子 |
| D、将饱和的FeCl3溶液滴入沸腾的NaOH溶液中可制得氢氧化铁胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
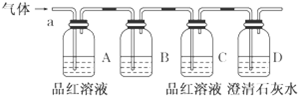
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
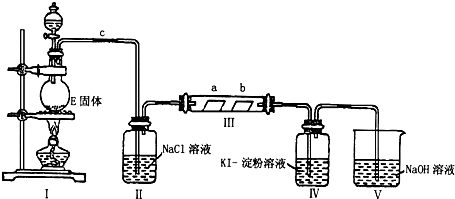
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始VA=VB=a L,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2N(g)+W(g),△H>0达到平衡时,v(A)=1.2aL,则下列说法错误的是( )
如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始VA=VB=a L,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2N(g)+W(g),△H>0达到平衡时,v(A)=1.2aL,则下列说法错误的是( )| A、反应开始时,B容器中化学反应速率快 |
| B、A容器中X的转化率为40%,且比B中X的转化率小 |
| C、打开K一段时间,达到新平衡时,A的体积为2.6aL(两边通管中气体体积不计) |
| D、打开K达新平衡后,升高B容器温度,A容器体积会增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/LNa2S2O3和H2SO4各5mL,加水5mL,反应温度10℃ |
| B、0.1mol/LNa2S2O3和H2SO4各5mL,加水10mL,反应温度10℃ |
| C、0.1mol/LNa2S2O3和H2SO4各5mL,加水5mL,反应温度30℃ |
| D、0.1mol/LNa2S2O3和H2SO4各5mL,加水10mL,反应温度30℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com