
【题目】H是由A和CH2=CH2为主要原料合成的一种高分子酯类物质,合成路线如下(部分产物及条件已略去):

已知:①A的结构简式为: 
②E分子的核磁共振氢谱峰有4个,峰面积比为3:3:1:1.
(1)A的化学名称为__________
(2)F的结构简式为_________,B到C的反应条件是_________
(3)生成G的反应类型为_________,H的结构简式是_______,若H的平均相对分子质量为25600,则H的平均聚合度约为________
(4)C![]() D的化学方程式为_________
D的化学方程式为_________
(5)E有多种同分异构体,其中符合下列条件的同分异构体共有________种。
①能发生水解反应和银镜反应
②没有环状结构
③不含![]() 结构。
结构。
(6)写出以乙二醇为基本原料(其他试剂自选)合成聚乙二酸乙二酯的合成路线图(参照乙烯转化为F的格式)_____.
【答案】 2-甲基-1-丁烯 CH3CH2OH NaOH水溶液、加热 取代反应 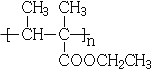 200
200 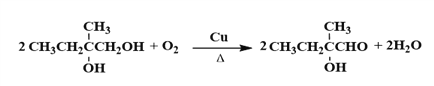 4
4 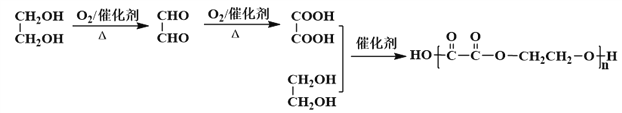
【解析】A与Br2/CCl4发生加成反应生成B: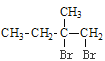 ;B在NaOH水溶液发生水解反应,生成C:
;B在NaOH水溶液发生水解反应,生成C: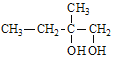 ;C在O2/Cu△的条件下转化为D,与亚甲基相连的羟基被氧化为羧基,所以D为:
;C在O2/Cu△的条件下转化为D,与亚甲基相连的羟基被氧化为羧基,所以D为: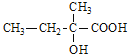 ;在浓硫酸加热的条件下D中的羟基脱水生成碳碳双键,则E为
;在浓硫酸加热的条件下D中的羟基脱水生成碳碳双键,则E为![]() ;F为乙醇,F与E在浓硫酸加热的条件下生成G,G为
;F为乙醇,F与E在浓硫酸加热的条件下生成G,G为![]() 。
。
综上所述,B为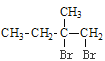 ,C为
,C为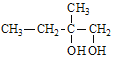 ,D为
,D为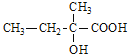 ,E为
,E为![]() ,G为
,G为![]() 。
。
(1)A为 ![]() ,化学名称为2-甲基-1-丁烯
,化学名称为2-甲基-1-丁烯
(2)F为乙醇,结构简式为CH3CH2OH,B到C为卤代烃的水解反应,反应条件是NaOH水溶液、加热
(3)生成G的反应为酯化反应,因此反应类型为取代反应,G→H为加聚反应,H的结构简式是 ,若H的平均相对分子质量为25600,则H的平均聚合度约为n=25600/128=200;
,若H的平均相对分子质量为25600,则H的平均聚合度约为n=25600/128=200;
(4)C![]() D是醇的催化氧化,叔醇不被氧化,化学方程式为
D是醇的催化氧化,叔醇不被氧化,化学方程式为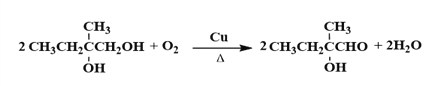
(5)①能发生水解反应说明含酯基,能发生银镜反应说明含有醛基,即应含有HCOO-结构,②没有环状结构,③不含![]() 结构。则满足要求的结构为:
结构。则满足要求的结构为:![]() 、
、![]() 、
、![]() 、
、![]() 共4种。
共4种。
(6)参照题中所给合成路线,乙二醇→乙二醛→乙二酸→聚乙二酸乙二酯,故合成路线图为:


科目:高中化学 来源: 题型:
【题目】下列关于纯净物、混合物、电解质、非电解质的正确组合为( )
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 盐酸 | 水煤气 | 硫酸 | 干冰 |
B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
C | 胆矾 | 盐酸 | 铁 | 碳酸钙 |
D | 胆矾 | 水煤气 | 氯化铜 | 碳酸钠 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )

A. 分子式为C7H6O5
B. 分子中含有2种官能团
C. 可发生加成和取代反应
D. 在水溶液中羧基和羟基均能电离出H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据实验目的所设计的实验操作中正确的是
A.检验NaCl中含有Na2CO3,加水溶解
B.鉴别NaCl和Na2CO3溶液,加适量盐酸
C.除去CaO中的CaCO3,加足量稀盐酸
D.除去CO2中少量的CO,通入O2,点燃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、W均为元素周期表中前四周期的元素,其原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质。回答下列问题(相关问题均用元素符号或化学式表示):
(1)R的基态原子的核外电子排布式是_____________________。
(2)Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是_______________。
(3)X与Z中电负性较大的是_________;Z的某种含氧酸盐常用于实验室中X单质的制取,此酸根离子的空间构型是__________,此离子中含有的化学键类型是__________;X—Z—X的键角______109°28'(填“>”“<”或“=”)
(4)X与Y形成的化合物Y2X的晶胞如图。其中X离子的配位数为_______,以距离一个X离子最近的所有Y离子为顶点构成的几何体为________。该化合物与MgO相比,熔点较高的是____________。
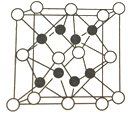
(5)已知该化合物的晶胞边长为a pm,则该化合物的密度为_________g/cm3。(列算式,不必计算出数值,阿伏伽德罗常数的数值为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为四个常用的电化学装置,关于它们的叙述正确的是
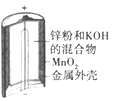
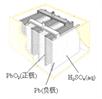
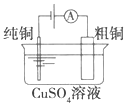
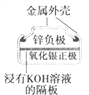
(a)碱性锌锰电池 (b)铅-硫酸蓄电池 (c)电解精炼铜 (d)银锌纽扣电池
A. 图(a)所示电池中,MnO2的作用是催化剂
B. 图(b)所示电池放电过程中,硫酸浓度不断增大
C. 图(c)所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图(d)所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下列各组离子在指定溶液中能大量共存的是
A. 无色透明的溶液中:Fe3+、Mg2+、SCN-、Cl-
B. c(H+)/c(OH﹣) =1×10-12的溶液中:K+、Na+、![]() 、
、![]()
C. c(Fe2+)=1 molL-1的溶液中:K+、![]() 、
、![]() 、
、![]()
D. 能使甲基橙变红的溶液中:Na+、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于物质分类的正确组合是( )
分类组合 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | 纯碱 | HCl | 烧碱 | 氧化铝 | 二氧化碳 |
B | 烧碱 | 硫酸 | 食盐 | 氧化镁 | 一氧化碳 |
C | 苛性钠 | 醋酸 | 碳酸铵 | 过氧化钠 | 二氧化硫 |
D | 苛性钾 | HCl | 小苏打 | 氧化钠 | 三氧化硫 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1mol/L的Na2SO3溶液300mL,恰好将2×10-2mol的XO4-离子还原,则元素X在还原产物中的化合价是
A.+1B.+2C.+3D.+4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com