
| A、上述四种元素的原子半径大小为X>Y>Z>W |
| B、化合物X2W2中存在两种类型的化学键 |
| C、依据最高价氧化物对应水化物的碱性强弱可以比较X和Y的金属性强弱 |
| D、W、Z的氢化物的沸点:HmW<HmZ |
| ||
| 1mol |
| ||
| 1mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
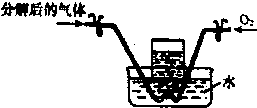 已知Fe(NO3)2受热分解产物为金属氧化物、NO2、O2.某兴趣小组同学对固体产物中Fe的化合物进行了如下探究:
已知Fe(NO3)2受热分解产物为金属氧化物、NO2、O2.某兴趣小组同学对固体产物中Fe的化合物进行了如下探究:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.24L CO2中含有的原子数为0.3×6.02×1023 |
| B、0.1L 3mol?L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023 |
| C、5.6g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023 |
| D、1.7g NH3中含有的化学键数目为0.3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、减少化石燃料的使用能减轻温室效应 |
| B、酸雨是指PH值小于7的雨水 |
| C、对煤炭进行脱硫处理后再做燃料能有效减少酸雨 |
| D、使用无氟冰箱可减缓臭氧空洞的产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大气雾霾污染现象的产生与汽车尾气排放有关 |
| B、玻璃和氮化硅陶瓷都属于新型无机非金属材料 |
| C、空气中的臭氧对人体健康有益无害 |
| D、活性炭与二氧化硫都可用于漂白,其漂白原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大力开发和利用生物质能,促进可再生能源的发展 |
| B、利用核能、水库、潮汐等发电,可以减少火力发电对煤等化石燃料的使用 |
| C、H2是理想的绿色能源,可用电解水的方法进行获得 |
| D、推广利用太阳能、风能的照明系统,有利于实现城市的“蓝天工程” |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制取溴苯:将铁屑、溴水、苯混合加热 |
| B、实验室制硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸 |
| C、用浓硫酸与乙醇混合液共热控制在170℃制乙烯气体 |
| D、用浓溴水可以除去苯中混有的苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| SaSO4 | BaSO4 | Sr(OH)2 | |
| Ksp | 3.3×10-7 | 1.1×10-10 | 3.2×10-4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com