
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子的基态电子排布式为 ,该元素的符号是 。
(2)Y元素原子的价层电子的电子排布图为 ,该元素的名称是 。
(3)X与Z可形成化合物XZ3,该化合物的空间构型为 。
(4)比较X的氢化物与同族第二、三周期元素所形成的氢化物的稳定性顺序(由大到小) ,沸点顺序(由高到低) 。
【答案】答(1)1s22s22p63s23p63d104s24p3As
(2)![]() 氧(3)三角锥形
氧(3)三角锥形
(4)稳定性:NH3>PH3>AsH3,沸点:NH3>AsH3>PH3
【解析】试题分析:X元素原子的4p轨道上有3个未成对电子,则可以知道X元素原子基态时的电子排布式为1s22s22p63s23p63d104s24p3,为As,Y元素原子的最外层2p轨道上有2个未成对电子,则元素原子基态时的电子排布式为1s22s22p4,为O,X、Y和Z三种元素的原子序数之和等于42,X原子序数为33,Y为8,则Z为H原子,X与Z可形成化合物AsH3,该化合物的空间构型和氨气相似,
(1)由以上分析可知X为As,电子排布式为1s22s22p63s23p63d104s24p3;
(2)Y为氧元素,原子的价层电子的轨道表示式为![]() ;
;
(3)X与Z可形成化合物AsH3,该化合物的空间构型和氨气相似,为三角锥型;
(4)X为N元素,非金属性较强,在同主族元素对应的氢化物中,对应的氢化物含有氢键,沸点较高,稳定性较大,因为键长越短,键能越大,化合物越稳定,则稳定性:NH3>PH3>AsH3,AsH3相对分子质量比PH3大,分子间作用力大,因而AsH3比PH3沸点高,则沸点:NH3>AsH3>PH3。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 某有机物燃烧只生成CO2和H2O,且二者的物质的量相等,则此有机物的组成为CnH2n
B. 相同质量的烃,完全燃烧,烃中碳的百分含量越高,消耗O2越少
C. 某气态 CxH4若与足量O2完全反应,则反应前后气体体积不变
D .烃在足量的氧气中燃烧并通过浓H2SO4,减少的体积就是生成的水蒸气的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学反应的说法正确的是( )
A.化学反应过程中,分子的种类一定发生改变
B.已知2A(g)+B(g)C(g)+D(s)△H<0,则该反应一定能自发进行
C.有化学键发生断裂,就有化学反应的发生
D.放热反应的反应速率一定比吸热反应的反应速率大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A.纯碱(Na2CO3)从物质的分类看不属于碱
B.由一种元素组成的物质一定是单质
C.凡是能电离出H+的化合物均属于酸
D.盐类物质一定含有金属离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。回答下列问题:
(1)基态P原子的核外电子排布式为__________,有______个未成对电子。写出磷及其同周期相邻元素第一电离能的大小顺序_________。
(2)磷的一种同素异形体——白磷(P4)的其键角为_________,推测其在CS2中的溶解度___________(填“大于”或“小于”)在水中的溶解度
(3)两种三角锥形气态氢化物膦(PH3)和氮(NH3)的键角分别为93.6°和107°,试分析PH3、的键角小于NH3的原因_________。写出一种与互为等电子体的阳离子_________。
(4)PCl3中心原子杂化轨道类型为________,VSEPR 模型为_______。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,下图为其立方体晶胞,其中的每个原子均满足8电子稳定结构,试判断其熔点______(填“高于”或“低于”)金刚石熔点。
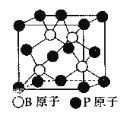
已知其B-P键长均为x cm,则其密度为_____g/cm3(列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4===FeSO4+H2↑的能量变化趋势如下图所示:

(1)该反应为________反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是__________(填字母)。
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为________极(填“正”或“负”)。铜电极上产生的现象为____________,该极上发生的电极反应为____________________,外电路中电子由____________极(填“正”或“负”,下同)向________极移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠、碳酸氢钠是日常生产生活中常用的两种盐。在实验室中制取NaHCO3的方法有多种。请
依据下列方法回答问题:
方法一:模拟工业“侯氏制碱法”制取:(原理NaCl+H2O+CO2+NH3 = NaHCO↓+NH4Cl)
第一步:连接好装置,检验气密性,在仪器内装人药品。
第二步:让某一装置先发生反应,直到产生的气体不能再在Ⅲ中溶解,再通入另一装置中产生的气体,片刻后,Ⅲ中出现固体。继续向Ⅲ中通入两种气体,直到不再有固体产生。
第三步:分离Ⅲ中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。

(1)图中所示装置的连接顺序是:a接f;e接________;b接_________(填接口编号)。
(2) I中盛放稀盐酸的仪器名称是_____________,IV中应选用的液体为________________。
(3 )第二步中让 _____________ (填序号)装置先发生反应。
(4)第四步中所加固体粉末为________。所得的晶体中常含有少置的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH4Cl。简要写出操作和现象______________________。
方法二:把CO2通人饱和Na2CO3溶液制取NaHCO3。装置如下图所示(气密性已检验,部分夹持装置略):

(5 )请结合化学平衡移动原理解释B中溶液的作用_________________。
(6)当C中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用。为确定固体的成分,实验小组设计方案如下(取一定量的固体,配成溶液作为样液,其余固体备用):
①方案1:取样液与澄清的Ca(OH)2溶液混合,出现白色沉淀。
实验小组对现象产生的原理进行分析,认为该方案不合理,理由是________________。
②方案2:取样液与BaCl2溶液混合,出现白色沉淀并有气体产生。
实验小组认为固体中存在NaHCO3,其离子方程式是________________。
方法三:(7)请你再写出一种实验室制取少量碳酸氢钠的方法(用相关的化学反应方程式来表示):__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com