

分析 (1)反应①②③均为水溶液中的置换反应,A、D、E均为金属单质且A在日常生活中应用广泛,E是主族元素形成的单质,各反应中消耗的金属与生成的金属物质的量相等,则A应为Fe,B可能为CuCl2,D为Cu,E为Mg,
①置换反应中较活泼金属置换出较不活泼金属,反应②发生Mg与Fe的反应Cl2;
②氢气还原FeO得到Fe和水;锥形瓶Ⅰ中发生Fe与稀硫酸的反应,II中发生硫酸亚铁与NaOH溶液的反应;
③氢氧化亚铁易被氧化;
(2)若反应①、②、③均为复分解反应,A、E均为常见的可溶性碱,溶液中形成的D是白色沉淀且D能溶解在E中,则A为NH3•H2O,E为NaOH,D为Al(OH)3,以此来解答.
解答 解:(1)反应①②③均为水溶液中的置换反应,A、D、E均为金属单质且A在日常生活中应用广泛,E是主族元素形成的单质,各反应中消耗的金属与生成的金属物质的量相等,则A应为Fe,B可能为CuCl2,D为Cu,E为Mg,
①置换反应中活泼金属置换出较不活泼金属,则A、D、E的还原性由强到弱的顺序为E>A>D,反应①为Fe+Cu2+═Fe2++Cu,反应②为Mg+Fe2+═Mg2++Fe,
故答案为:E>A>D;Mg+Fe2+═Mg2++Fe;
②H2还原A0制备纳米级α-A粉的化学方程式为H2+FeO$\frac{\underline{\;高温\;}}{N_{2}}$Fe+H2O,锥形瓶Ⅰ中发生Fe与稀硫酸的反应,II中发生硫酸亚铁与NaOH溶液的反应,则I中试剂为稀硫酸和铁粉,使两瓶内液体混合的操作为点燃II处导管氢气较纯时,关闭止水夹,
故答案为:H2+FeO$\frac{\underline{\;高温\;}}{N_{2}}$Fe+H2O;稀硫酸和铁粉;点燃II处导管氢气较纯时,关闭止水夹;
③A(OH)2存放时最终仍会变质,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(2)①②③均为复分解反应,且A、E均为常见的碱,溶液中形成的D是白色沉淀,则A为NH3•H2O,E为NaOH,D为Al(OH)3,反应①为3NH3•H2O+AlCl3═3NH4Cl+Al(OH)3↓,反应②为NH4Cl+NaOH═NH3•H2O+NaCl,
故答案为:3NH3•H2O+AlCl3═3NH4Cl+Al(OH)3↓;NH4Cl+NaOH═NH3•H2O+NaCl.
点评 本题考查无机物的推断,为高频考点,把握常见物质的性质及相互转化为解答的关键,侧重金属单质置换反应、铝及其化合物转化、铁及其化合物转化的考查,综合性较强,题目难度中等.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:填空题
 图中A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,e、f为铂电极.接通电路后,发现B上的c点显红色.试回答:
图中A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,e、f为铂电极.接通电路后,发现B上的c点显红色.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XO3-中X为+5价,故X元素位于第VA族 | |
| B. | X位于第二周期第VIIA族 | |
| C. | X可能是氯元素 | |
| D. | X可能是氮元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2 | B. | O2 | C. | H2O | D. | CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 、
、 ;
; 、
、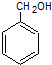 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在同温同压下,相同体积的任何气体所含的原子数相同 | |
| B. | 相同条件下,N2和O2的混合气体与等体积的N2所含原子数相等 | |
| C. | 等物质的量的NH4+和OH-所含质子数相等且电子数也相等 | |
| D. | 1mol 乙基中含有的电子数为18NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由同种元素组成的物质一定属于纯净物 | |
| B. | NaHCO3在水中电离:NaHCO3═Na++H++CO32- | |
| C. | 含金属元素的离子不一定都是阳离子 | |
| D. | 具有相同质子数的微粒都属于同种元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com