
【题目】燃煤烟气的脱硫脱硝是目前研究的热点。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H= -574 kJmol-1
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H= -1160 kJmol-1
③H2O(g) = H2O(l) △H= -44 kJmol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O( l ) 的热化学方程式_____________。
(2)某科研小组研究臭氧氧化--碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+ O3(g) ![]() NO2(g)+O2(g) △H1 = -200.9 kJmol-1 Ea1 = 3.2 kJmol-1
NO2(g)+O2(g) △H1 = -200.9 kJmol-1 Ea1 = 3.2 kJmol-1
反应Ⅱ:SO2(g)+ O3(g)![]() SO3(g)+O2(g) △H2 = -241.6 kJmol-1 Ea2 = 58 kJmol-1
SO3(g)+O2(g) △H2 = -241.6 kJmol-1 Ea2 = 58 kJmol-1
已知该体系中臭氧发生分解反应:2O3(g) ![]() 3O2(g)。请回答:
3O2(g)。请回答:
其它条件不变,每次向容积为2L的反应器中充入含1.0 mol NO、1.0 mol SO2的模拟烟气和2.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:
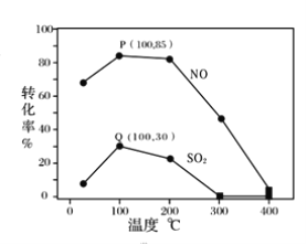
①由图可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_______。
②下列说法正确的是________。
A.P点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若缩小反应器的容积可提高NO和SO2的转化率
③假设100℃时P、Q均为平衡点,此时反应时间为10分钟,发生分解反应的臭氧占充入臭氧总量的10%,则体系中剩余O3的物质的量是________mol;NO的平均反应速率为________;反应Ⅱ在此时的平衡常数为_______________。
(3)用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入如图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能:
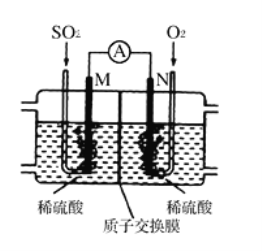
①M极发生的电极反应式为___________________。
②当外电路通过0.2 mol电子时,质子交换膜左侧的溶液质量_____(填“增大”或“减小”)____克。
【答案】 CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(l) △H=-955 kJ/mol 反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应 BC 0.65 0.0425mol/(L·min) 0.96 SO2+2H2O-2e- =SO42- +4H+ 增大 6.2
【解析】(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574 kJmol-1,②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160 kJmol-1,③H2O(g)═H2O(l)△H=-44.0 kJmol-1,根据盖斯定律,将![]() ×(①+②+③×4)得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=
×(①+②+③×4)得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=![]() ×[(-574 kJmol-1)+(-1160 kJmol-1)+(-44.0 kJmol-1)×4]=-955kJmol-1,故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=-955kJmol-1;
×[(-574 kJmol-1)+(-1160 kJmol-1)+(-44.0 kJmol-1)×4]=-955kJmol-1,故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=-955kJmol-1;
(2)①反应Ⅰ:NO(g)+ O3(g) ![]() NO2(g)+O2(g) △H1 = -200.9 kJmol-1 Ea1 = 3.2 kJmol-1
NO2(g)+O2(g) △H1 = -200.9 kJmol-1 Ea1 = 3.2 kJmol-1
反应Ⅱ:SO2(g)+ O3(g)![]() SO3(g)+O2(g) △H2 = -241.6 kJmol-1 Ea2 = 58 kJmol-1,反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应,因此相同温度下NO的转化率远高于SO2,故答案为:反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应;
SO3(g)+O2(g) △H2 = -241.6 kJmol-1 Ea2 = 58 kJmol-1,反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应,因此相同温度下NO的转化率远高于SO2,故答案为:反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应;
②A.图中曲线属于描点法所得图像,P点不一定为图像的最高点,即不一定为平衡状态点,可能是建立平衡过程中的一点,故A错误;B.根据图像,温度高于200℃后,2O3(g) ![]() 3O2(g)反应进行程度加大,体系中的臭氧浓度减小,NO和SO2的转化率随温度升高显著下降、当臭氧完全分解,则二者转化率几乎为零,故B正确;C.其它条件不变,若缩小反应器的容积,使得2O3(g)
3O2(g)反应进行程度加大,体系中的臭氧浓度减小,NO和SO2的转化率随温度升高显著下降、当臭氧完全分解,则二者转化率几乎为零,故B正确;C.其它条件不变,若缩小反应器的容积,使得2O3(g) ![]() 3O2(g)平衡逆向移动,臭氧浓度增大,反应Ⅰ:NO(g)+ O3(g)
3O2(g)平衡逆向移动,臭氧浓度增大,反应Ⅰ:NO(g)+ O3(g) ![]() NO2(g)+O2(g) 和反应Ⅱ:SO2(g)+ O3(g)
NO2(g)+O2(g) 和反应Ⅱ:SO2(g)+ O3(g)![]() SO3(g)+O2(g)平衡正向移动, NO和SO2的转化率提高,故C正确;故选BC;
SO3(g)+O2(g)平衡正向移动, NO和SO2的转化率提高,故C正确;故选BC;
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJmol-1
③反应Ⅰ:NO(g)+ O3(g) ![]() NO2(g)+O2(g)中NO的转化率为85%,则反应的NO为0.85mol,O3为0.85mol;反应Ⅱ:SO2(g)+ O3(g)
NO2(g)+O2(g)中NO的转化率为85%,则反应的NO为0.85mol,O3为0.85mol;反应Ⅱ:SO2(g)+ O3(g)![]() SO3(g)+O2(g)中SO2的转化率为30%,反应的SO2为0.3mol,O3为0.3mol,2O3(g)
SO3(g)+O2(g)中SO2的转化率为30%,反应的SO2为0.3mol,O3为0.3mol,2O3(g) ![]() 3O2(g)中发生分解反应的臭氧占充入臭氧总量的10%,为
3O2(g)中发生分解反应的臭氧占充入臭氧总量的10%,为![]() =0.0425mol/(L·min);平衡是为0.85mol+0.30mol+0.3mol=1.45mol,反应Ⅱ的平衡常数=
=0.0425mol/(L·min);平衡是为0.85mol+0.30mol+0.3mol=1.45mol,反应Ⅱ的平衡常数=![]() =0.96,故答案为:0.65;0.0425mol/(L·min);0.96;
=0.96,故答案为:0.65;0.0425mol/(L·min);0.96;
(3)①本质是二氧化硫、氧气与水反应生成硫酸,M电极为负极,N电极为正极,M电极上二氧化硫失去电子氧化生成SO42-,根据原子守恒会电荷守恒可知,有水参加反应,有氢离子生成,电极反应式为:SO2+2H2O-2e -═SO42-+4H+,故答案为:SO2+2H2O-2e -═SO42-+4H+;
②负极反应式为:SO2+2H2O-2e -═SO42-+4H+,正极反应式为O2 + 4e-- + 4H+ == 2H2O,当外电路通过0.2 mol电子时,负极反应的二氧化硫为0.1mol,质量为6.4g,同时有0.2mol氢离子通过质子交换膜进入右侧,左侧溶液质量增大6.4g-0.2g=6.2g,故答案为:增大;6.2。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】将0.2mol MnO2和50mL 12mol·L-1盐酸混合后缓慢加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀,物质的量为x mol(不考虑盐酸的挥发),则x的取值范围是
A.x=0.3B.x<0.3C.0.3<x<0.6D.以上结论都不对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
![]()
从A出发发生图示中的一系列反应,其中B和C按1:2反应生成Z。F和E按1:2反应生成W,F的核磁共振氢谱只有两种峰,W和Z互为同分异构体。
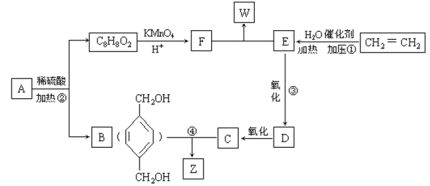
回答下列问题:
(1)写出反应类型:①_____________________,②______________________________。
(2)写出下列反应的化学方程式:
③_____________________________________________________;
④_____________________________________________________。
(3)与B互为同分异构体,属于酚类且苯环上只有两个取代基的化合物有___种(不包括对映异构体)。
(4)A的结构简式可能为_________________________________。
(5)已知酯与醇有如下反应:
RCOOR′+R″OH![]() RCOOR″+R′OH(R、R′、R″代表烃基)
RCOOR″+R′OH(R、R′、R″代表烃基)
B与W在上述条件下可形成高分子化合物Q,请写出B与W生成Q的化学方程式________。
(6)同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮:
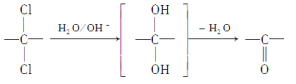
根据已有知识并结合相关信息,写出以对二甲苯为原料(其他无机试剂任选)制备![]() 的合成路线。__________________
的合成路线。__________________
合成路线示意图,如: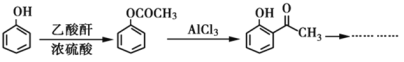
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组依据反应AsO43-+2I-+2H+![]() AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
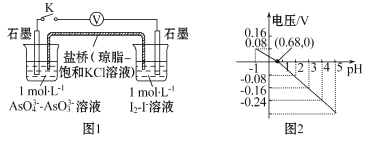
A.调节pH可以改变反应的方向
B.pH=0.68时,反应处于平衡状态
C.pH=5时, 负极电极反应式为2I--2e -= I2
D.pH>0.68时,氧化性I2>AsO43-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种锂钒氧化物热电池装置,电池总反应为xLi+LiV3O8=Li1+xV3O8。工作时,需先引发铁和氯酸钾反应使共晶体熔化,下列说法不正确的是( )
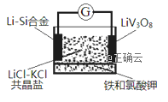
A. 放电时LiV3O8电极反应为:xLi++LiV3O8-xe-=Li1+xV3O8
B. 整个过程的能量转化涉及化学能转化为热能和电能
C. 组装该电池应当在无水、无氧的条件下进行
D. 充电时Cl-移向LiV3O8电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是石油裂解气的主要成分之一,以A为原料制备药物中间体X的合成路线如下:
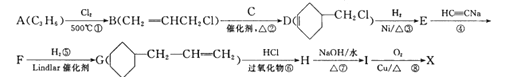
已知i.
ii.![]() 。
。
回答下列同题:
(1)A的结构简式为_________,B的名称为__________,D中含有的官能团的名称是___________。
(2)有机物I的结构简式为___________;反应④的反应类型是___________。
(3)由A生成B的化学方程式为______________________________________。
(4)反应⑧的化学方程式为___________________________________________。
(5)满足以下条件的X的同分异构体有___________种。
i.能发生银镜反应;
ii.含有六元环结构;
iii.六元环上有2个取代基。
其中核磁共振氢谱中有6组峰,且峰面积之比为4:4:3:2:2:1的有机物的结构简式为________(任写一种)。
(6)参照F的合成路线,以CH3CH=CHCH3为原料设计制备 的合成路线:__________(其他试剂任选)。
的合成路线:__________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种装置中,溶液的体积均为250mL,开始时电解质溶液的浓度均为0.10mol/L,工作一段时间后,测得导线上均通过0.02mol电子,若不考虑溶液体积的变化,则下列叙述正确的是( )
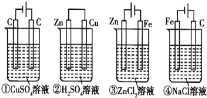
A. 工作一段时间后溶液的浓度:①=②=③=④
B. 工作一段时间后溶液的pH:④>③>①>②
C. 产生气体的总体积:④>③>①>②
D. 电极上析出固体的质量:①>②>③>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如图所示。溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以Zn(NH3)42+、Cu(NH3)42+、Cd(NH3)42+、AsCl52-的形式存在。
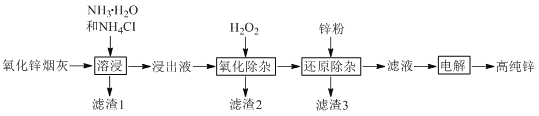
注:“氧化除杂”中,AsCl52-转化为As2O5胶体吸附聚沉除去,溶液始终接近中性。
回答下列问题:
(1)Zn(NH3)42+中Zn的化合价为________,“溶浸”中ZnO发生反应的离子方程式为________。
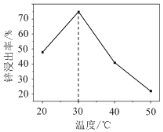
(2)锌浸出率与温度的关系如图所示,分析30 ℃时锌浸出率最高的原因为________。
(3)“滤渣3”的主要成分为________。
(4)“电解”时Zn(NH3)42+在阴极放电的电极反应式为_______。阳极区放出一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是________(写化学式)。电解后的电解液经补充________(写一种物质的化学式)后可返回“溶浸”工序继续使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近在-100 ℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键)。下列说法正确的是
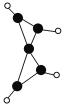
A. X既能使溴的四氯化碳溶液褪色,又能使酸性KMnO4溶液褪色
B. X是一种常温下能稳定存在的液态烃
C. X和戊烷类似,容易发生取代反应
D. 充分燃烧等质量的X和甲烷,甲烷消耗氧气较多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com