
����Ŀ�������ܽ�����п�̻���ȡ�ߴ�п�Ĺ���������ͼ��ʾ���ܽ�������п�̻���п��ͭ���ӡ���Ԫ�طֱ���Zn(NH3)42+��Cu(NH3)42+��Cd(NH3)42+��AsCl52������ʽ���ڡ�
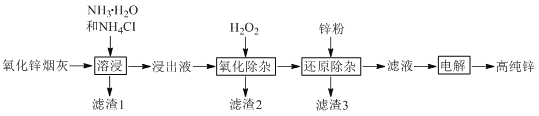
ע�����������ӡ��У�AsCl52��ת��ΪAs2O5���������۳���ȥ����Һʼ�սӽ����ԡ�
�ش��������⣺
��1��Zn(NH3)42+��Zn�Ļ��ϼ�Ϊ________�����ܽ�����ZnO������Ӧ�����ӷ���ʽΪ________��
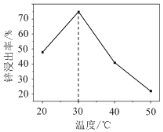
��2��п���������¶ȵĹ�ϵ��ͼ��ʾ������30 ��ʱп��������ߵ�ԭ��Ϊ________��
��3��������3������Ҫ�ɷ�Ϊ________��
��4������⡱ʱZn(NH3)42+�������ŵ�ĵ缫��ӦʽΪ_______���������ų�һ����ɫ��ζ�����壬����ͨ�����KSCN��FeCl2��Һ�У�����������������________��д��ѧʽ��������ĵ��Һ������________��дһ�����ʵĻ�ѧʽ����ɷ��ء��ܽ����������ʹ�á�
���𰸡�+2 ZnO+2NH3��H2O+2NH4+=Zn(NH3)42++3 H2O ����30��ʱ���ܽ���Ӧ�������¶����߶�������30�棬�����ݳ������ܽ���Ӧ�����½� Cu��Cd Zn(NH3)42++2e-=Zn+4 NH3����Zn(NH3)42++2e-+4H2O= Zn+4NH3��H2O N2 NH3����NH3��H2O��
��������
����п�̻��м��백ˮ���Ȼ���ܽ�������п�̻���п��ͭ���ӡ���Ԫ�طֱ���Zn(NH3)42+��Cu(NH3)42+��Cd(NH3)42+��AsCl52������ʽ���ڣ�����Һ�м���˫��ˮ��AsCl52��ת��ΪAs2O5���������۳���ȥ����Һʼ�սӽ����ԣ�����п�۽�Cd��Cu�û����������˳�����������Һ����ҪΪZn(NH3)42+�����Ϳɵõ��ߴ�п��
��1��Zn(NH3)42+��Zn�Ļ��ϼ�Ϊ+2�ۣ������ܽ�����ZnO�백ˮ������Ӧ����Zn(NH3)42+�����ӷ���ʽ�� ZnO+2NH3��H2O+2NH4+=Zn(NH3)42++3H2O ��
�𰸣�+2 ZnO+2NH3��H2O+2NH4+=Zn(NH3)42++3H2O
��2���¶�Խ�ߣ���Ӧ��Ũ��Խ��ѧ��Ӧ����Խ�죬������ҲԽ�ߣ���ˮ���ȶ������ֽ��ݳ�������
�𰸣�����30��ʱ���ܽ���Ӧ�������¶����߶�������30�棬�����ݳ������ܽ���Ӧ�����½�
��3������п�۽�Cd��Cu�û����������˳�����������Һ����ҪΪZn(NH3)42+������������Cd��Cu��
�𰸣� Cu��Cd
��4�������Ҫ��õ��ߴ�п���������Zn(NH3)42+�õ�������п������ʧ���ӷų�һ����ɫ��ζ�����壬����ͨ�����KSCN��FeCl2��Һ�У�����������˵������������ʧ���ӻ��ϼ������ߵ�ֻ��NԪ�شӸ��������ߵ�0�ۣ�����N2��������Zn(NH3)42++2e-=Zn+4NH3��������:2NH3��H2O-6e-=N2+2H2O+6H+,����ĵ��Һ���� NH3����NH3��H2O����ɷ��ء��ܽ����������ʹ�á�
�𰸣�Zn(NH3)42++2e-=Zn+4NH3����Zn(NH3)42++2e-+4H2O=Zn+4NH3��H2O N2 NH3����NH3��H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��K2SO4��Al2(SO4)3������Һ��c(K+)=0.2mol��L-1��c(SO42-)=0.7mol��L-1��
��д��Al2(SO4)3�ĵ��뷽��ʽ____________��
��c(Al3+)����______mol��L-1��
��2����ʳ���г����и����ӡ�þ���ӡ���������ӵȿ����������⣬��������ɳ�Ȳ��������ʡ�����ʳ�õľ������ô�ʳ���ᴿ���õ��ġ��ش��������⡣
�ٳ�ȥMg2+����Ҫ����ļ���ҺΪ��������ѡ����ѡ���𰸣�����ĸ����ͬ����___����ȥSO42-����Ҫ���������ҺΪ��______��
A��NaOH B��KOH C��BaCl2 D��Ba(NO3)2
�ھ��������ٺ��ټ��뱥��Na2CO3��Һ��ֱ�����ٲ�������Ϊֹ���ⲽ������Ŀ���ǣ���ȥ_____��_____������д���ӷ��ţ�
�۽����������ں������Һ���ˣ���Һ�л����������ʣ��������Һ�м�����������Һ�ǣ������ʻ�ѧʽ��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼú����������������Ŀǰ�о����ȵ㡣
��1����CH4����ԭ��������������������������Ⱦ����֪��
��CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) ��H= -574 kJmol-1
��CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) ��H= -1160 kJmol-1
��H2O(g) = H2O(l) ��H= -44 kJmol-1
д��CH4(g)��NO2(g)��Ӧ����N2(g)��CO2(g)��H2O( l ) ���Ȼ�ѧ����ʽ_____________��
��2��ij����С���о���������--�����շ�ͬʱ�ѳ�SO2��NO���գ��������̷�Ӧԭ������Ӧ�ȡ�����������£�
��Ӧ��NO(g)+ O3(g) ![]() NO2(g)+O2(g) ��H1 = -200.9 kJmol-1 Ea1 = 3.2 kJmol-1
NO2(g)+O2(g) ��H1 = -200.9 kJmol-1 Ea1 = 3.2 kJmol-1
��Ӧ��SO2(g)+ O3(g)![]() SO3(g)+O2(g) ��H2 = -241.6 kJmol-1 Ea2 = 58 kJmol-1
SO3(g)+O2(g) ��H2 = -241.6 kJmol-1 Ea2 = 58 kJmol-1
��֪����ϵ�г��������ֽⷴӦ��2O3(g) ![]() 3O2(g)����ش�
3O2(g)����ش�
�����������䣬ÿ�����ݻ�Ϊ2L�ķ�Ӧ���г��뺬1.0 mol NO��1.0 mol SO2��ģ��������2.0 mol O3���ı��¶ȣ���Ӧ��ͬʱ��t����ϵ��NO��SO2��ת������ͼ��ʾ��
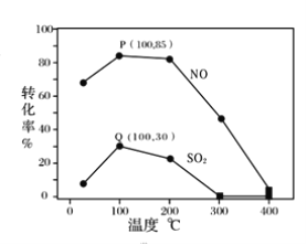
����ͼ��֪��ͬ�¶���NO��ת����Զ����SO2������������ݷ��������ԭ��_______��
������˵����ȷ����________��
A��P��һ��Ϊƽ��״̬��
B���¶ȸ���200����NO��SO2��ת�������¶����������½������Ϊ��
C�������������䣬����С��Ӧ�����ݻ������NO��SO2��ת����
������100��ʱP��Q��Ϊƽ��㣬��ʱ��Ӧʱ��Ϊ10���ӣ������ֽⷴӦ�ij���ռ�������������10%������ϵ��ʣ��O3�����ʵ�����________mol��NO��ƽ����Ӧ����Ϊ________����Ӧ���ڴ�ʱ��ƽ�ⳣ��Ϊ_______________��
��3���õ绯ѧ��ģ�ҵ����SO2�������Ṥҵβ���е�SO2ͨ����ͼװ�ã��缫��Ϊ���Բ��ϣ�����ʵ�飬�������Ʊ����ᣬͬʱ��õ��ܣ�
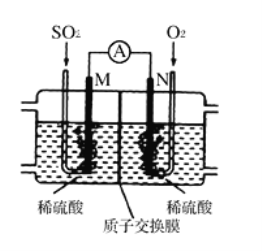
��M�������ĵ缫��ӦʽΪ___________________��
�������·ͨ��0.2 mol����ʱ�����ӽ���Ĥ������Һ����_____������������������С����____�ˡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(SeO2)��һ�����������䱻��ԭ��ĵ��������ܳ�Ϊ������Ⱦ�ͨ����ŨHNO3��ŨH2SO4��Ӧ����SeO2�Ի���Se��
��֪����Se��2H2SO4(Ũ)===2SO2����SeO2��2H2O��
��2SO2��SeO2��2H2O===Se��2SO42����4H+��
(1) Se��ŨH2SO4�ķ�Ӧ�У���������________________����ԭ����_______________�����б�״����22.4 L SO2��������ʱ��ת�Ƶ��ӵ����ʵ�����________ mol��
(2)���ݷ�Ӧ�������ж�SeO2��ŨH2SO4��SO2����������ǿ������˳����______________________��
(3)�õ����ŷ������Ӧ�ڵ���ת�Ƶķ������Ŀ��_____________________________��
(4)SeO2��KI��HNO3�������·�Ӧ��SeO2��KI��HNO3�D��Se��I2��KNO3��H2O��ƽ������Ӧ�Ļ�ѧ����ʽ______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��һ�������£�28.80g��������A��1.20molCl2��ɷ�Ӧ������1.20molAClx����x=__________����Aԭ�Ӻ�����������������������Aԭ�Ӻ���������Ϊ__________ ����ԭ�ӽṹʾ��ͼΪ____________��
(2)���а���3.4g���ڱ�״���������Ϊ____________�����е�ԭ�ӵ���ĿΪ_____ ��������ȫ������ˮ�����500mL��Һ������Һ�����ʵ���Ũ��Ϊ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�������������
��1����ϵͳ�����������������ʻ��������л��������д����ṹ��ʽ��
��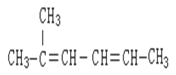 _________________________��
_________________________��
��![]() _____________��
_____________��
��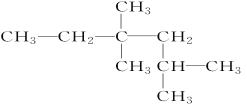 _____________________________��
_____________________________��
��2�����и��������У�������ͬλ�ص��ǣ�����ĸ����ͬ��________��������ͬ�����������________ ���ۻ�Ϊͬϵ�����__________ ��������ͬ���칹�����____________ ��������ͬ�����ʵ���____________ ��
A��O2��O3
B��![]() ��
��![]()
C��CH3CH2C��CH �� CH3CH(CH3)2
D��![]() ��
��![]()
E. 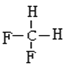 ��
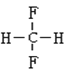
��
F. 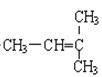 ��CH2=CH-CH3
��CH2=CH-CH3
G.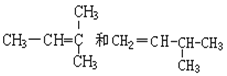
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ij�о���ѧϰС�������ȡ������������Ϊ��Ӧ������ض���Ӧ��װ�á�
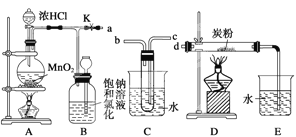
(1)Ҫ��Cװ�ý���B��D֮�䣬��ȷ�Ľӷ��ǣ�a��___��____��d��
(2)ʵ�鿪ʼ�ȵ�ȼA���ľƾ��ƣ�������K����Cl2��������װ�ã��ٵ�ȼD���ľƾ��ơ�Cl2ͨ��Cװ�ú����D��Dװ����ʢ��̿�ۣ�����������ԭ��Ӧ������CO2��HCl(g)��������Ӧ�Ļ�ѧ����ʽΪ______________________��
Ϊ��ʹCװ�÷��Ӹ��õ����ã������ձ��м���Ũ���ᣬ����Ũ�����������_____________________________________________��
(3)D����Ӧ��Ϻر�����K����ȥ�����ƾ��ƣ��������ȵ����ã�A����������Cl2 ��������ʱB�е�������____��B��������______________________��
(4)����Ͳ��ȡ20 mL E����Һ�������Ѽ����ķ�Һ©���У�Ȼ����ע��10 mL CCl4���Ǻò�����(��ͼ)��������������̨�ϣ��ȷֲ��ȡ�ϲ�Һ���²�Һ���ʻ���ɫ����____(�����ϲ�Һ�������²�Һ��)����װ����ͼ��ʾ���ձ��У���ʹ��ɫ������ɫ����____(�����ϲ�Һ�������²�Һ��)��
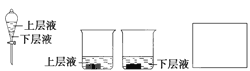
(5)��A��B��C��D��Eװ������һ����Ҫ�Ľ���˵����Ҫ�Ľ�������______________________________,���ڷ����л����Ľ����װ��ͼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�����������������ȷ���ǣ� ��
A. 78gNa2O2�����������������Ӹ���Ϊ2NA
B. 1.5gCH3+�к��еĵ�����ΪNA
C. 3.4g�����������0.6NA��N��H��
D. �����£�100mL1mol��L-1AlCl3��Һ��Al3+������������0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.�������и����������������ݣ��ɷֱ��������Һ�����ʵ�������������Һ�����ʵ����ʵ���Ũ�ȣ����жϲ���⡣
��1����֪ij����������ҺVL�к���n�����������ӣ����������Һ��___��___��
��2����֪ij����������Һ��Na+��H2O�ĸ���֮��Ϊ1��a������������Һ��___Ϊ___��
��.�����£�10.0mL1.0molL-1��H2SO4(aq)����ˮϡ�͵�500mL������H2SO4��Һ��Ũ��Ϊ___molL-1������Ũ��ʹ��Һ�����Ϊ2.40mL������H2SO4��Һ��Ũ��Ϊ___molL-1�����������С�����һλ��
��.��֪��״����1���ˮ���ܽ�500������Ȼ��⣬��������״�����Ȼ��ⱥ����Һ�����ʵ���������Ϊ___�����������С�����һλ��
��.����һ������ˮ��Һ�����ܺ������������еļ��֣�K+��NH4+��Cl-��Mg2+��Ba2+��CO32-��SO42-��ȡ���ݸ�100mL��Һ��������ʵ�飺 ��һ�ݼ���AgNO3��Һ�г����������ڶ��ݼ�����NaOH��Һ���Ⱥ��ռ���![]() ���壻�����ݼ�����
���壻�����ݼ�����![]() ��Һ�õ��������
��Һ�õ��������![]() ������������ϴ�ӡ������������Ϊ
������������ϴ�ӡ������������Ϊ![]() ��
��
�û��Һ��һ������___�����ܺ�___����n��K+��___����ȡֵ��Χ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com