
【题目】Ⅰ.根据下列各题中所给出的数据,可分别求出其溶液中溶质的质量分数或溶液中溶质的物质的量浓度,试判断并求解。
(1)已知某氢氧化钠溶液VL中含有n个氢氧根离子,可求出此溶液的___是___。
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1:a,则可求出此溶液的___为___。
Ⅱ.常温下,10.0mL1.0molL-1的H2SO4(aq),加水稀释到500mL,所得H2SO4溶液的浓度为___molL-1;蒸发浓缩使溶液的体积为2.40mL,所得H2SO4溶液的浓度为___molL-1。(结果保留小数点后一位)
Ⅲ.已知标准状况下1体积水能溶解500体积的氯化氢,则可求出标准状况下氯化氢饱和溶液中溶质的质量分数为___。(结果保留小数点后一位)
Ⅳ.现有一混合物的水溶液,可能含有以下离子中的几种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-现取三份各100mL溶液进行如下实验: 第一份加入AgNO3溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到![]() 气体;第三份加足量
气体;第三份加足量![]() 溶液后,得到干燥沉淀
溶液后,得到干燥沉淀![]() ,经足量盐酸洗涤、干燥后,沉淀质量为
,经足量盐酸洗涤、干燥后,沉淀质量为![]() 。
。
该混合液中一定含有___,可能含___,且n(K+)___(填取值范围)
【答案】溶质的物质的量浓度 ![]() mol/L 溶质的质量分数
mol/L 溶质的质量分数 ![]() ×100% 0.02 4.2 44.9% K+、NH4+、CO32-、SO42- Cl- ≥0.04mol
×100% 0.02 4.2 44.9% K+、NH4+、CO32-、SO42- Cl- ≥0.04mol
【解析】
Ⅰ.(1)若某氢氧化钠溶液VL中含有n个OH-,根据氢氧根离子和氢氧化钠的关系式知,n(NaOH)=![]() mol,溶液的体积为VL,因为不知溶液的密度,所以只能计算出溶质的物质的量浓度,c=
mol,溶液的体积为VL,因为不知溶液的密度,所以只能计算出溶质的物质的量浓度,c=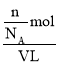 =
=![]() mol/L;
mol/L;
(2)氢氧化钠溶液中Na+与H2O的个数之比为1:a,结合原子守恒知,NaOH与H2O的物质的量之比为1:a,则氢氧化钠和水的质量之比=(40g/mol×1):(18g/mol×a)=20:9a,所以可求溶质的质量分数,w=![]() ×100%;
×100%;
Ⅱ.根据溶液的稀释定律,溶液稀释或浓缩前后溶质的质量和物质的量不变:c1V1=c2V2=c3V3,
稀释到500mL时,c2(H2SO4)=![]() =
=![]() =0.02mol·L-1;
=0.02mol·L-1;
浓缩到2.40mL时,c3(H2SO4)= ![]() =
=![]() =4.2mol·L-1;
=4.2mol·L-1;
Ⅲ.标准状况下1体积水能溶解500体积的氯化氢,假设水的体积是1L,氯化氢的体积是500L,水的质量是1000g,氯化氢的质量=![]() ×36.5g/mol,溶质和溶剂的质量都已知,所以能计算溶液的质量分数,质量分数=
×36.5g/mol,溶质和溶剂的质量都已知,所以能计算溶液的质量分数,质量分数=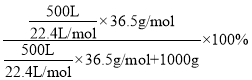 =44.9%。
=44.9%。
IV.第一份加入AgNO3溶液有沉淀产生,与AgNO3溶液有沉淀产生,则至少含Cl-、CO32-、SO42-中的一种;
第二份加足量NaOH溶液加热产生气体,气体是氨气,溶液中一定含有NH4+,且物质的量为0.08mol;
第三份加入足量BaCl2溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g,可知不溶于盐酸的4.66g为硫酸钡,物质的量为![]() =0.02mol;12.54g沉淀是硫酸钡和碳酸钡,碳酸钡质量为12.54g-4.66g=7.88g,碳酸钡的物质的量为
=0.02mol;12.54g沉淀是硫酸钡和碳酸钡,碳酸钡质量为12.54g-4.66g=7.88g,碳酸钡的物质的量为![]() =0.04mol,故原溶液中一定存在CO32-、SO42-;
=0.04mol,故原溶液中一定存在CO32-、SO42-;
由电荷守恒可知,正电荷为:n(+)=n(NH4+)=0.08mol;c(-)=2c(CO32-)+2c(SO42-)=2×0.04mol+2×0.02mol=0.12mol,正电荷总物质的量小于负电荷,故原溶液中一定有K+,至少为0.04mol;
综上所述,该混合液中一定含有K+、NH4+、CO32-、SO42-;可能含有Cl-;且n(K+)≥0.04mol。


科目:高中化学 来源: 题型:
【题目】氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如图所示。溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以Zn(NH3)42+、Cu(NH3)42+、Cd(NH3)42+、AsCl52-的形式存在。
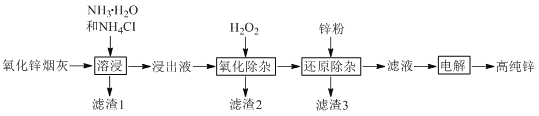
注:“氧化除杂”中,AsCl52-转化为As2O5胶体吸附聚沉除去,溶液始终接近中性。
回答下列问题:
(1)Zn(NH3)42+中Zn的化合价为________,“溶浸”中ZnO发生反应的离子方程式为________。
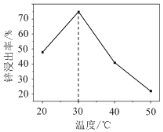
(2)锌浸出率与温度的关系如图所示,分析30 ℃时锌浸出率最高的原因为________。
(3)“滤渣3”的主要成分为________。
(4)“电解”时Zn(NH3)42+在阴极放电的电极反应式为_______。阳极区放出一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是________(写化学式)。电解后的电解液经补充________(写一种物质的化学式)后可返回“溶浸”工序继续使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近在-100 ℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键)。下列说法正确的是
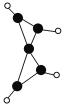
A. X既能使溴的四氯化碳溶液褪色,又能使酸性KMnO4溶液褪色
B. X是一种常温下能稳定存在的液态烃
C. X和戊烷类似,容易发生取代反应
D. 充分燃烧等质量的X和甲烷,甲烷消耗氧气较多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
![]()
下列说法不正确的是![]()
![]()
A. 反应①中![]() 是氧化剂
是氧化剂
B. 两个反应中硫元素均被氧化
C. 氧化性:![]()
D. 反应①、②中生成等量的![]() 时转移电子数之比为1:5
时转移电子数之比为1:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饱和烃A和不饱和烃B在常温下均为气体,其中A含的碳原子数多于B。将A、B按一定比例混合,1L混合气体完全燃烧后在同温同压下得到3.6LCO2。
(1)试推断该混合气体的可能组成及A、B混合时的体积比,将结果填入表中。_______________________
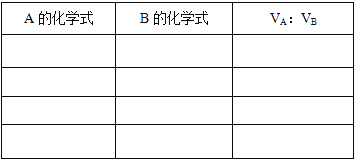
(2)1mol该混合气体恰好能使含0.2mol溴的四氯化碳溶液完全褪色,则A和B的化学式分别为________和_________。
(3)1mol该混合气体在氧气中完全燃烧,得到68.4g水,则A和B的化学式分别为_________和__________。
(4)120℃时,1LA和1LB与足量O2混合后点燃,在同温同压下体积增大2L,则A和B的化学式分别为_________和_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数,下列说法正确的是
A. 2.3gNa在足量的氧气中充分燃烧,转移的电子数为0.2NA
B. 标准状况下,22.4 L水中含有的氧原子数为NA
C. 1L 0.5molL﹣1的AlCl3溶液中所含Cl数目为3NA
D. 0.1 mol 氯气所含有的原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
称取A 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: |
(1)A的相对分子质量为:________。 | |
(2)将此9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g | (2)A的分子式为:________。 |
(3)另取A 9.0 g,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况) | (3)写出A中含有的官能团____________、________。 |
(4)A的核磁共振氢谱如下图: | A中含有4种氢原子。 |
(4)综上所述,A的结构简式为________。 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某盐酸试剂瓶上的标签如图所示。下列有关说法正确的是(设NA表示阿伏加德罗常数的值( )
盐酸
分析纯(AR)
体积:500ml
化学式:HCl
相对分子质量:36.5
质量分数:36.5%
密度:1.19g.ml-1
A.该浓度的盐酸可用广口瓶盛装
B.该盐酸的物质的量浓度为1.19g.ml-1
C.用该盐酸配制250ml2.0mol/L的稀盐酸时需选用100ml的量筒
D.该盐酸中所含Cl-的数目为5.95NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com