
【题目】某盐酸试剂瓶上的标签如图所示。下列有关说法正确的是(设NA表示阿伏加德罗常数的值( )
盐酸
分析纯(AR)
体积:500ml
化学式:HCl
相对分子质量:36.5
质量分数:36.5%
密度:1.19g.ml-1
A.该浓度的盐酸可用广口瓶盛装
B.该盐酸的物质的量浓度为1.19g.ml-1
C.用该盐酸配制250ml2.0mol/L的稀盐酸时需选用100ml的量筒
D.该盐酸中所含Cl-的数目为5.95NA
 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.根据下列各题中所给出的数据,可分别求出其溶液中溶质的质量分数或溶液中溶质的物质的量浓度,试判断并求解。
(1)已知某氢氧化钠溶液VL中含有n个氢氧根离子,可求出此溶液的___是___。
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1:a,则可求出此溶液的___为___。
Ⅱ.常温下,10.0mL1.0molL-1的H2SO4(aq),加水稀释到500mL,所得H2SO4溶液的浓度为___molL-1;蒸发浓缩使溶液的体积为2.40mL,所得H2SO4溶液的浓度为___molL-1。(结果保留小数点后一位)
Ⅲ.已知标准状况下1体积水能溶解500体积的氯化氢,则可求出标准状况下氯化氢饱和溶液中溶质的质量分数为___。(结果保留小数点后一位)
Ⅳ.现有一混合物的水溶液,可能含有以下离子中的几种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-现取三份各100mL溶液进行如下实验: 第一份加入AgNO3溶液有沉淀产生;第二份加足量NaOH溶液加热后,收集到![]() 气体;第三份加足量
气体;第三份加足量![]() 溶液后,得到干燥沉淀
溶液后,得到干燥沉淀![]() ,经足量盐酸洗涤、干燥后,沉淀质量为
,经足量盐酸洗涤、干燥后,沉淀质量为![]() 。
。
该混合液中一定含有___,可能含___,且n(K+)___(填取值范围)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种离效消毒剂、漂白剂在实验室中可用如图装置制备。.
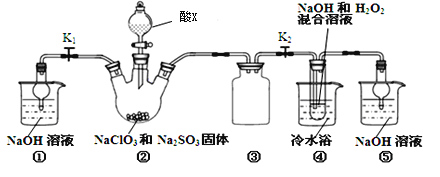
(1)装置②中酸X可以为_____________。
A.盐酸 B.H2SO4 C.HNO3 D.H2C2H4溶液
(2)写出装置②中产生ClO2的离子方程式_____________________。
(3)装置③的作用是_____________,装置④采用冷水欲的原因是__________________。
(4)由装置④反应后的溶液可得到NaClO2晶体,其实验步骤为:
ⅰ.减压,蒸发结晶;ⅱ.___________;ⅲ.热水洗涤;ⅳ.低温干燥,得到成品
(已知低温时NaClO2饱和溶液中会析出NaClO2·3H2O。)
(5)ClO2可用于氧化工厂污水中所含CN-,生成两种无毒无害的气体,写出其离子反应方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A. 用惰性电极电解MgCl2溶液:2Cl—+H2O通电 2OH—+Cl2↑+H2↑
B. SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O=SO42-+2I-+4H+
C. 氯气通入冷水中:Cl2 +H2O ![]() Cl- +ClO- +2H+
Cl- +ClO- +2H+
D. 碳酸镁悬浊液中加醋酸:CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )
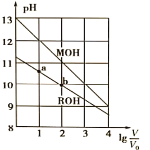
A. MOH的碱性强于ROH的碱性
B. ROH的电离程度:b点大于a点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CH4和 H2O为原料制备二甲醚和甲醇的工业流程如下:
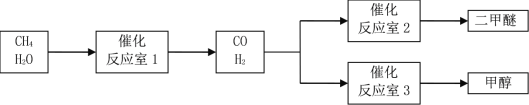
已知:2CO(g)+O2(g)=2CO2(g)△H=-566 kJ·mol-1,CH3OCH3 (g)+3O2(g)=2CO2(g)+3H2O (g) △H=-1323 kJ·mol-1,2H2(g)+O2(g)=2H2O(g)△H=-484 kJ·mol-1。
(1)反应室3中发生反应:CO(g)+2H2(g)=CH3OH(g)。该反应在一定条件下能自发进行的原因是_____。
(2)反应室2中发生反应:2CO(g)+4H2(g)=CH3OCH3(g)+H2O (g) △H=_____。
(3)反应室1中发生反应:CH4(g)+H2O (g) ![]() CO(g)+3H2(g)。对此反应进行如下研究:T℃时,向容积为2 L的密闭容器中充入一定量的CH4(g)和H2O (g)进行反应,实验测得反应过程中的部分数据见下表(表中t1<t2):
CO(g)+3H2(g)。对此反应进行如下研究:T℃时,向容积为2 L的密闭容器中充入一定量的CH4(g)和H2O (g)进行反应,实验测得反应过程中的部分数据见下表(表中t1<t2):
反应时间/min | n(CH4)/mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
①反应从开始到t1分钟时的平均反应速率为v(H2)=_______mol·L-1·min-1。
②若保持其他条件不变,起始时向容器中充入0.60 mol CH4和1.20 mol H2O,反应一段时间后,测得容器中H2的物质的量为0.60 mol,则此时v正______v逆(填“>”、“<”或“=”)。
③若上述反应改变某一条件,测得H2的物质的量随时间变化见图中曲线B(A为原反应的曲线),则改变的条件可能是_________。
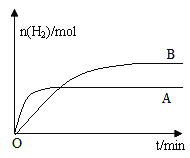
(4)以反应室1出来的CO和H2为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质构成的一种碳酸盐燃料电池如右上图所示。
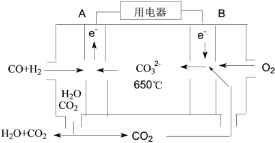
①该电池的正极反应式为_____。
②若电路中流过4 mol电子,则理论上消耗CO和H2的总体积为________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷分子中的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )
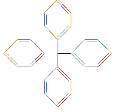
A. 分子式为C25H20
B. 所有碳原子不可能都在同一平面上
C. 完全燃烧生成CO2与H2O的物质的量之比为5∶2
D. 此物质不属于芳香烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A. 雕刻玻璃的试剂主要成分的电子式为:![]()
B. 新制氯水中含氧酸的结构式:H—Cl—O
C. S2-的结构示意图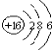
D. 标准状况下密度为1.25g/L的气态烃的球棍模型:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
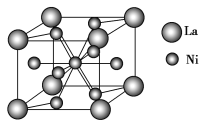
【题目】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为____________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO________FeO(填“<”或“>”);
(3)NiO晶胞中Ni和O的配位数分别为________、________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示。该合金的化学式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com