
【题目】甲烷分子中的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )
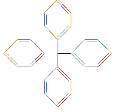
A. 分子式为C25H20
B. 所有碳原子不可能都在同一平面上
C. 完全燃烧生成CO2与H2O的物质的量之比为5∶2
D. 此物质不属于芳香烃
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数,下列说法正确的是
A. 2.3gNa在足量的氧气中充分燃烧,转移的电子数为0.2NA
B. 标准状况下,22.4 L水中含有的氧原子数为NA
C. 1L 0.5molL﹣1的AlCl3溶液中所含Cl数目为3NA
D. 0.1 mol 氯气所含有的原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值。下列说法正确的是
A. 18g D2O和18g H2O中含有的质子数均为10NA
B. 2 L 0.5molL1亚硫酸溶液中含有的H+离子数为2NA
C. 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
D. 密闭容器中,催化剂作用下2mol SO2与1mol O2充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某盐酸试剂瓶上的标签如图所示。下列有关说法正确的是(设NA表示阿伏加德罗常数的值( )
盐酸
分析纯(AR)
体积:500ml
化学式:HCl
相对分子质量:36.5
质量分数:36.5%
密度:1.19g.ml-1
A.该浓度的盐酸可用广口瓶盛装
B.该盐酸的物质的量浓度为1.19g.ml-1
C.用该盐酸配制250ml2.0mol/L的稀盐酸时需选用100ml的量筒
D.该盐酸中所含Cl-的数目为5.95NA
查看答案和解析>>
科目:高中化学 来源: 题型:
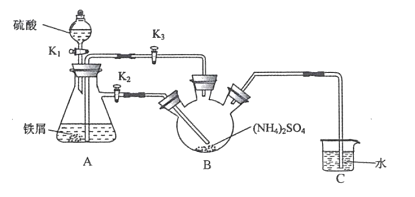
【题目】莫尔盐[(NH4)2Fe(SO4)26H2O,Mr=392]是一种重要的还原剂,在空气中比一般的亚铁盐稳定。某学习小组设计如下实验制备少量的莫尔盐并测定其纯度。
回答下列问题:
Ⅰ制取莫尔盐
(1)连接装置,检査装置气密性。将0.1mol(NH4)2SO4,晶体置于玻璃仪器中______(填仪器名称),将6.0g洁浄铁屑加人锥形瓶中。
(2)①打开分液漏斗瓶塞,关闭活塞K3,打开K2、K1,加完55.0mL2mol·L-1稀硫酸后关闭K1。A装置中反应的离子方程式为____
②待大部分铁粉溶解后,打开K3、关闭K2,此时可以看到的现象为_______,原因是_______
③关闭活塞K2、K3,采用100℃水浴蒸发B中水分,液面产生晶膜时,停止加热,冷却结晶、____、用无水乙醇洗涤晶体。该反应中硫酸需过量,保持溶液的pH在1~2之间,其目的为____
④装置C的作用为 ____,装置C存在的缺点是____
Ⅱ.测定莫尔盐样品的纯度
(3)称取所得莫尔盐样品10.0g,用煮沸后冷却的蒸馏水配成100mL溶液,取20.00mL溶液加人稀硫酸,用0.1molL-1的KMnO4溶液滴定,达到滴定终点时消耗10.00mlKMnO4溶液。滴定反应的离子方程式为____,该样品的纯度为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Na+、Ba2+、Cu2+、CO32-、Cl-、Mg2+中的一种或几种离子。
①向此溶液中滴加足量稀盐酸无明显现象。
②取少许①的溶液并加入少量的Na2SO4溶液,有白色沉淀产生。
③取②的上层清液并加入足量的NaOH溶液,有白色沉淀产生。
(1)原溶液中一定含有的离子是________,一定不含有的离子是________,不能确定是否含有的离子是________。
(2)②中反应的离子方程式为___________________。
(3)若另取10mL①的溶液于锥形瓶中,然后向此溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。
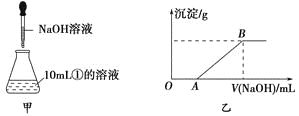
①OA段反应的离子方程式为_____________________。
②AB段反应的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)写出下列物质的化学式:漂白粉的有效成分_______;小苏打________。
(2)写出下列微粒的结构示意图:N________;S2-________。
(3)写出下列物质的电离方程式或者化学方程式:
NH3·H2O的电离方程式________;
镁条在二氧化碳中反应的化学方程式________。
(4)写出分离或提纯下列各组混合物时所需方法的名称:
①分离四氯化碳和水________;
②提取溴水中的溴单质________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
B.标准状况下,11.2 L CCl4中含有分子的数目为0.5NA
C.2 L 0.5 mol· L-1硫酸钾溶液中阴离子所带电荷数为NA
D.标准状况下,22.4 L氨水含有NA个NH3分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KI是一种重要的食品添加剂,工业上可以通过铁屑法生产,其工艺流程如下:
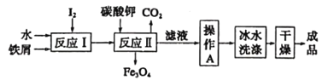
下列说法错误的是
A.若反应Ⅱ是非氧化还原反应,则反应Ⅰ的产物是![]()
B.操作A是蒸发浓缩,冷却结晶,过滤
C.用冰水洗涤的目的是为了缩短产品干燥的时间
D.干燥的装置可以是干燥器
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com