
【题目】按要求填空
(1)写出下列物质的化学式:漂白粉的有效成分_______;小苏打________。
(2)写出下列微粒的结构示意图:N________;S2-________。
(3)写出下列物质的电离方程式或者化学方程式:
NH3·H2O的电离方程式________;
镁条在二氧化碳中反应的化学方程式________。
(4)写出分离或提纯下列各组混合物时所需方法的名称:
①分离四氯化碳和水________;
②提取溴水中的溴单质________。
【答案】Ca(ClO)2 NaHCO3 ![]()
![]() NH3·H2O
NH3·H2O![]() NH4++OH- 2Mg+CO2
NH4++OH- 2Mg+CO2![]() C+2MgO 分液 萃取
C+2MgO 分液 萃取
【解析】
(1)漂白粉的成分是CaCl2、Ca(ClO)2,有效成分是Ca(ClO)2;小苏打是碳酸氢钠的俗称。
(2)原子核外电子分层排布,原子核外电子数等于原子核内质子数,S原子获得2个电子变为S2-。据此书写微粒的结构示意图。
(3)NH3·H2O是弱电解质,存在电离平衡;;
镁条在二氧化碳中燃烧产生MgO和C单质;
(4)四氯化碳和水是互不相溶的液体物质,据此判断分离方法;
根据溴单质容易溶于有机物,有机物与水不相溶的性质进行分离。
(1)漂白粉的成分是氯化钙、次氯酸钙,有效成分是次氯酸钙,化学式是Ca(ClO)2;小苏打是碳酸氢钠的俗称,化学式是NaHCO3。
(2) N是7号元素,N原子核外电子排布是![]() ;S是16号元素,S原子获得2个电子变为S2-,S2-核外电子排布式是:
;S是16号元素,S原子获得2个电子变为S2-,S2-核外电子排布式是:![]() 。
。
(3)NH3·H2O是弱电解质,存在电离平衡,电离产生NH4+、OH-,电离方程式为:NH3·H2O![]() NH4++OH-;
NH4++OH-;
镁条在二氧化碳中燃烧产生MgO和C单质,反应方程式为:2Mg+CO2![]() C+2MgO;
C+2MgO;
(4)四氯化碳和水是互不相溶的液体物质,可用分液方法分离;
由于溴单质容易溶于有机物CCl4,而CCl4与水互不相溶,可向该混合物中加入CCl4,充分振荡后静止,溴进入有机物CCl4,从而使水与溴单质分离,这种分离方法叫萃取。


科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是:( )
①金属钠、氢气都能在氯气中燃烧,生成白色的烟雾;②铜丝在氯气中燃烧,生成蓝绿色的氯化铜;③液氯就是氯气的水溶液,它能使干燥的有色布条褪色;④久置的氯水,因氯气几乎完全挥发掉,剩下的就是水
A.①B.①②C.①③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )
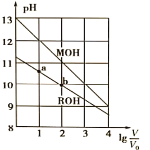
A. MOH的碱性强于ROH的碱性
B. ROH的电离程度:b点大于a点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷分子中的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )
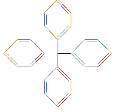
A. 分子式为C25H20
B. 所有碳原子不可能都在同一平面上
C. 完全燃烧生成CO2与H2O的物质的量之比为5∶2
D. 此物质不属于芳香烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在日常生活和生产中应用广泛,结合相关知识回答下列问题:
I.根据反应①~③,回答下列问题:
①Cl2+2KI=2KCl+I2 ②2FeCl2+Cl2=2FeCl3 ③2FeCl3+2HI=2FeCl2+2HCl+I2
(1)反应②的反应类型为___(填字母)。
A.置换反应 B.复分解反应 C.分解反应 D.氧化还原反应
(2)对于反应③,氧化产物是___,还原产物是___。
(3)根据上述三个反应可判断出Cl-、I-、Fe2+三种物质的还原性由强到弱顺序为___。
II.实验室可以用 KMnO4固体和浓盐酸反应制取少量Cl2,反应的化学方程式为:__KMnO4+__HCl(浓)-__KCl+__MnCl2+__Cl2↑+__H2O,回答下列问题:
(1)请配平上述化学方程式。___
(2)浓盐酸在反应中表现的性质是___。
(3)该反应中氧化剂和还原剂的物质的量之比为___。
III.饮用水中NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O,请回答下列问题:
(1)上述反应中,被还原的物质是___。
(2)用双线桥标出反应中电子转移的方向和数目。___
(3)上述反应中若标准状况下产生11.2L气体,则转移电子的数目为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A. 雕刻玻璃的试剂主要成分的电子式为:![]()
B. 新制氯水中含氧酸的结构式:H—Cl—O
C. S2-的结构示意图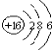
D. 标准状况下密度为1.25g/L的气态烃的球棍模型:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁电池作为一种低成本、高安全的储能装置,正受到国内外广大科研人员的关注。一种以固态含Mg2+的化合物为电解质的镁电池的总反应如下。下列说法错误的是
xMg+V2O5 ![]() MgxV2O5
MgxV2O5
A. 充电时,阳极质量减小
B. 充电时,阴极反应式:Mg2++2e-=Mg
C. 放电时,正极反应式为:V2O5+xMg2++2xe-=MgxV2O5
D. 放电时,电路中每流过2mol电子,固体电解质中有2molMg2+迁移至正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是五种由![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的不同的阴阳离子组成,且均易溶于水的物质,分别取它们的水溶液进行实验,现象如下:
中的不同的阴阳离子组成,且均易溶于水的物质,分别取它们的水溶液进行实验,现象如下:
①分别向五种溶液中加入稀盐酸,C、E均有气泡产生,且E的液面上出现红棕色气体
②C、D混合时,剧烈反应,同时产生白色沉淀和大量气体;A、C混合时,仅有刺激性气味气体产生
③少量A与D混合时,产生白色沉淀,过量A与D混合时,无现象
回答下列问题:
(1)实验①,C中产生的气体是________________(填化学式)。
(2)物质A、D的化学式分别是_____________,________________。
(3)C、D混合时发生反应的离子方程式是__________________________。
(4)将A、E的溶液在烧杯中混合,其现象是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com