
【题目】下列说法中,不正确的是:( )
①金属钠、氢气都能在氯气中燃烧,生成白色的烟雾;②铜丝在氯气中燃烧,生成蓝绿色的氯化铜;③液氯就是氯气的水溶液,它能使干燥的有色布条褪色;④久置的氯水,因氯气几乎完全挥发掉,剩下的就是水
A.①B.①②C.①③④D.①②③④
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A. 乙烯使溴水褪色说明乙烯与溴发生了取代反应
B. 乙烯的结构简式为CH2CH2
C. 甲烷、乙烯和苯的分子中原子都在同一平面上
D. “西气东输”中的“气”主要成分是甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚制备两种方法原理如下
第一种方法:丹麦Topspe工艺的合成气一步法,是专门针对天然气原料开发的一项新技术。
①2CH4(g)+O2(g)![]() CH3OCH3(g)+H2O(g) △H1
CH3OCH3(g)+H2O(g) △H1
第二种方法:二甲醚生产二步法,即先合成甲醇,甲醇在催化剂下制二甲醚。
②CO(g)+2H2(g)![]() CH3OH(g) △H2
CH3OH(g) △H2
③2CH3OH(g)![]() CH3OCH3 (g)+H2O(g) △H3
CH3OCH3 (g)+H2O(g) △H3
(1)若由合成气(CO、H2)直接制备 1molCH3OCH3(g),且生成H2O(1),整个过程中放出的热量为244kJ,则△H2=___________kJ·mol-1。(已知:H2O(1)=H2O(g) △H=+44.0 kJ/mol)
(2)下列有关反应①叙述不正确的是___________
a.达到平衡后,升高温度,ν正减少、ν逆增大,平衡逆向移动
b.当四种物质的浓度相等,反应达到化学平衡状态
c.若改变条件,反应物的转化率一定增大,正反应速率一定大于逆反应速率
d.当达到平衡时2v正(O2)=v逆(CH4)
e.向该恒容平衡体系中充入氩气,ν正、ν逆均增大,平衡向右移动
(3)有人模拟制备原理Ⅱ,绘制如图甲图像:
i说明CO的转化率随温度升高先增大后减小的原因:______________________。
ii.反应②自发进行的条件是______________________。
iii.若在350℃时的2L的密闭容器中充入2 mol CO和6molH2,8min达到平衡,c(CH3OCH3)=0.3mol·L-1,用H2表示反应②的速率是___________;可逆反应③的平衡常数K3=___________。
iv.若350℃时测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)___________ν(逆),说明原因_________。
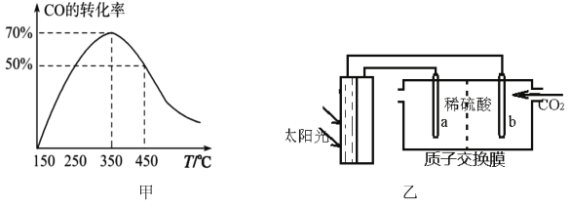
(4)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成二甲醚的光能储存装置如图乙所示则b极的电极反应式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,尿素电氧化法处理富含尿素的工业废水和生活污水得到了广泛关注,该法具有操作简易、处理量大、运行周期长等优点,且该过程在碱性条件下产生无毒的C02、N2.电池工作时,下列说法错误的是( )

A. 负极发生的反应为:![]()
B. 正极附近溶液的pH增大
C. 隔膜只允许阳离子通过
D. 处理掉废水中尿素1.0g时消耗O2 0.56L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。查阅资料知:
①Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
②向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3。
③BaSO3难溶于水,可溶于稀HCl。
实验装置如图所示(省略夹持装置)
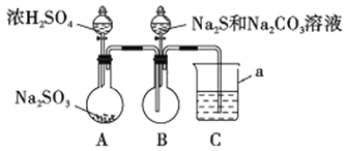
(1)仪器a的名称是_________;C中的试剂可以是______ (选填下列字母编号)。
A.稀H2SO4 B.酸性KMnO4溶液 C.饱和NaHSO3溶液 D.NaOH溶液
(2)此实验装置设计有缺陷,其改进方法是_________________________。
(3)写出B中反应的离子方程式_________________________________________。
(4)A、B中反应完后,在拆装置前,应将其中污染空气的有毒气体除去,采用的方法和具体操作是________________________________________。
(5)该法所得产品中常含有少量Na2SO3和Na2SO4。为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,加足量BaCl2溶液,有白色沉淀生成,_______________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(6)测定产品纯度:准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol/L碘的标准溶液滴定。(反应原理为:2S2O32-+I2=S4O62-+2I-)
①滴定至终点时,溶液颜色的变化是_______________________。
②滴定记录数据如下表:
滴定前读数/mL | 滴定后读数/mL | |
第一次 | 0.10 | 16.12 |
第二次 | 1.10 | 17.08 |
第三次 | 1.45 | 19.45 |
第四次 | 0.00 | 16.00 |
③产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:用NH3催化还原NOx时包含以下反应。
反应①:4NH3(g) + 6NO(g) ![]() 5N2(g) + 6H2O(l) H1 = -1807.0kJmol-1
5N2(g) + 6H2O(l) H1 = -1807.0kJmol-1
反应②:4NH3(g) + 6NO2(g) ![]() 5N2(g) + 3O2(g) + 6H2O(l) H2 = ?
5N2(g) + 3O2(g) + 6H2O(l) H2 = ?
反应③:2NO(g) + O2(g) ![]() 2NO2(g) H3 = -113.0kJmol-1
2NO2(g) H3 = -113.0kJmol-1
(1)反应②的H2 =_________________________。 反应①②在热力学上趋势大,其原因是___________________________________________________________________。
(2)为探究温度及不同催化剂对反应①的影响,分别在不同温度、不同催化剂下,保持其它初始条件不变重复实验,在相同时间内测得N2浓度变化情况如下图所示。

①反应①的平衡常数的表达式K=__________。在催化剂甲的作用下反应的平衡常数_______________在催化剂乙的作用下反应的平衡常数(填写“大于”,“小于”或“等于”)。
②N点后N2浓度减小的原因可能是_________________、 ________________。
(3)某温度下,在1L容器中对于反应①初始投入4molNH3和6molNO,当气体总物质的量为7.5mol时反应达到平衡,则NH3的转化率_______________% ,达平衡所用时间为5分钟,则用NO表示此反应平均反应速率为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com