
����Ŀ�������������һ����Ҫ�Ļ�����Ʒ��ij��ȤС�����Ʊ���������ƾ���(Na2S2O3��5H2O)����������֪��
��Na2S2O3��5H2O����ɫ������,������ˮ,��ϡ��Һ��BaCl2��Һ����������ɡ�
����Na2CO3��Na2S�����Һ��ͨ��SO2���Ƶ�Na2S2O3��
��BaSO3������ˮ,������ϡHCl��
ʵ��װ����ͼ��ʾ(ʡ�Լг�װ��)
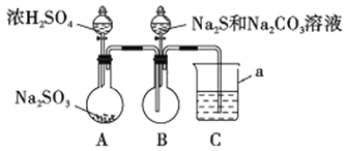
��1������a��������_________;C�е��Լ�������______ (ѡ��������ĸ���)��
A��ϡH2SO4 B������KMnO4��Һ C������NaHSO3��Һ D��NaOH��Һ
��2����ʵ��װ�������ȱ��,��Ľ�������_________________________��
��3��д��B�з�Ӧ�����ӷ���ʽ_________________________________________��
��4��A��B�з�Ӧ���,�ڲ�װ��ǰ��Ӧ��������Ⱦ�������ж������ȥ,���õķ����;��������________________________________________��
��5���÷����ò�Ʒ�г���������Na2SO3��Na2SO4��Ϊ��֤��Ʒ�к���Na2SO3��Na2SO4,��С�����������ʵ�鷽��,�뽫��������������(�����Լ���ϡHNO3��ϡH2SO4��ϡHCl������ˮ��ѡ��)
ȡ������Ʒ���ϡ��Һ��������BaCl2��Һ,�а�ɫ�������ɣ�_______________��������δ��ȫ�ܽ�,���д̼�����ζ���������,���ȷ����Ʒ�к���Na2SO3��Na2SO4��
��6���ⶨ��Ʒ���ȣ�ȷ��ȡWg��Ʒ,����������ˮ�ܽ�,�Ե�����ָʾ��,��0.1000mol/L��ı���Һ�ζ���(��Ӧԭ��Ϊ��2S2O32-+I2=S4O62-+2I-)
�ٵζ����յ�ʱ,��Һ��ɫ�ı仯��_______________________��
�ڵζ���¼�������±���
�ζ�ǰ����/mL | �ζ������/mL | |
��һ�� | 0.10 | 16.12 |
�ڶ��� | 1.10 | 17.08 |
������ | 1.45 | 19.45 |
���Ĵ� | 0.00 | 16.00 |
�۲�Ʒ�Ĵ���Ϊ(��Na2S2O3��5H2O��Է�������ΪM)______________��
���𰸡� �ձ� BD ��AB��BC֮�����ӷ������İ�ȫƿ CO32-+2S2-+4SO2=3S2O32-+CO2 ����A����ƿ��������NaHCO3��Һ,�ٵμ�ϡH2SO4,ֱ��������CO2���彫װ���������ž�Ϊֹ ����,������ˮϴ�ӳ���,������м�������ϡHCl ����ɫ����ɫ�����ڰ�����ڲ���ɫ ![]() %
%
��������(1) ����a���������ձ���װ��A�в�����SO2��װ��B�еĻ����Һ��Ӧ����B�г����������г���CO2�⣬�����ܺ���H2S��SO2���ж�����Ⱦ���������壬����װ��C����β�����գ�H2S��SO2�����л�ԭ�ԣ�������������������KMnO4��Һ��Ӧ��ˮ��Һ���������ԣ�����Ӧ������װ��C�е��Լ�ΪB��D��
(2)ʵ������У�������һ���ȶ�������Ӧ��AB��BC֮�����ӷ������İ�ȫƿ��
(3) B�з�Ӧ�����ӷ���ʽCO32-+2S2-+4SO2=3S2O32-+CO2��
(4)Ϊ��ȥװ���ڵ��ж����壬���������彫װ���ڲ�����������װ��C�У����в�����������A����ƿ��������NaHCO3��Һ���ٵμ�ϡH2SO4��ֱ��������CO2���彫װ���������ž�Ϊֹ��
(5)���������˳�������������ˮϴ�ӣ�Ȼ��������м�������ϡHCl��������δ��ȫ�ܽ⣬���д̼�����ζ��������������ȷ����Ʒ�к���Na2SO3��Na2SO4��
(6)�ٸ��ݷ�Ӧԭ��2S2O32-+I2=S4O62-+2I-���õ�����ָʾ�����յ�ʱ��Һ��ɫ�ı仯������ɫ����ɫ�����ڰ�����ڲ���ɫ���ڷ����Ĵ�ʵ�����ݿ�֪��������ʵ���������̫�����ţ���������������ʵ������������õ�ˮ����Һ�����Ϊ16.00mL����n(I2)=1.6��10-3mol�����Բ�Ʒ�Ĵ���=![]() ��100%=
��100%= ![]() %��
%��


 �ظ���ʦ�㲦ϵ�д�
�ظ���ʦ�㲦ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����11.6 g Fe3O4 Ͷ�뵽150 mLijŨ�ȵ�ϡH2SO4������Ͷ��5.6 g�����ռ���1.12 L H2����״������ͬʱ��Fe��Fe3O4����ʣ����Ϊ���к�������������ʹ��Һ����Ԫ����ȫ������������4 mol/L��NaOH��Һ150 mL����ԭ������Һ�����ʵ���Ũ��Ϊ
A. 1.5 mol/L B. 0.5 mol/L C. 2 mol/L D. 1.2 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������25mLNaOH��Һ����μ���0.2mol/LCH3COOH��Һ��������ҺpH�ı仯������ͼ��ʾ��

��1����NaOH��Һ�����ʵ���Ũ��Ϊ_________________��
��2��a____12.5mL���>������<����=���������������ȵ��������ƺʹ�����Һ��϶���ǡ�ó�����
��3����D����Һ�и�����Ũ���ɴ�С˳��Ϊ_____________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ�������ӵ������Li+Ƕ�뻯����Ϊ���������Ķ��ε�ء���ͼΪһ�־ۺ�������ӵ��ʾ��ͼ,�乤��ԭ��ΪLiNiO2+6C![]() Li1-xNiO2+LixC6������˵������ȷ���ǣ� ��
Li1-xNiO2+LixC6������˵������ȷ���ǣ� ��

A. ��طŵ����ʱ��ͨ����̬�߷��ӵ���ʵ�����Li+
B. һ��ʱ����Li0.4C6ת��ΪLi0.9C6�������Ƿŵ����
C. ���ʱ,������ӦΪLiNiO2-xe-=Li1-xNiO2+xLi+
D. �õ�ع������������ظ�����������﮳���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ���У���̬ԭ�ӵļ۲�����Ų�ʽ����ȷ����(����)
A. As��4s24p3 B. Cr��3d44s2 C. Ga��4s24p1 D. Ni��3d84s2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(CH3OCH3)����Ϊ21���͵�����ȼ�ϣ���CO��H2Ϊԭ��������������Ҫ��������������Ӧ��
��ѧ��Ӧ����ʽ | ��ѧƽ�ⳣ�� | |
��CO(g)��2H2(g) | ��H1=-99 kJmol-1 | K1 |
��2CH3OH(g) | ��H2����24 kJmol-1 | K2 |
��CO(g)��H2O(g) | ��H3����41 kJmol-1 | K3 |
��1���ù��յ��ܷ�ӦΪ3CO(g)��3H2(g)![]() CH3OCH3(g)��CO2(g) ��H
CH3OCH3(g)��CO2(g) ��H
�÷�Ӧ��H��__________________����ѧƽ�ⳣ��K��____________________(�ú�K1��K2��K3�Ĵ���ʽ��ʾ)��
��2��ij�¶��£���8.0molH2��4.0molCO�����ݻ�Ϊ2L���ܱ������У�������Ӧ��4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g)��10 ���Ӻ�Ӧ��ƽ�⣬��ö����ѵ��������Ϊ25%����CO��ת����Ϊ________��
CH3OCH3(g)+H2O(g)��10 ���Ӻ�Ӧ��ƽ�⣬��ö����ѵ��������Ϊ25%����CO��ת����Ϊ________��
��3�����д�ʩ�У������CH3OCH3���ʵ���________��
A������������� B�������¶� C�����ø�Ч���� D������ѹǿ
��4���ù����з�Ӧ�۵ķ��������CH3OCH3�IJ��ʣ�ԭ����_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ļ���������������Ϳ�ѧʵ����Ӧ�ù㷺��
��1��һ��������Fe2O3����鷴Ӧ��ȡ������,ͬʱ����CO��H2����֪��
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ��H=-27.6kJ/mol
CH4(g)+H2O(g)=CO(g)+3H2(g) ��H=+206.4kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) ��H=-41.0kJ/mol
�ٷ�ӦFe2O3(s)+3CH4(g)![]() 2Fe(s)+3CO(g)+6H2(g)�ġ�H=________��
2Fe(s)+3CO(g)+6H2(g)�ġ�H=________��
�����÷�Ӧ��5L���ܱ������н���,5min��ﵽƽ��,�����ϵ�й�����������0.96g����ö�ʱ����CO��ƽ����Ӧ����Ϊ________��
�����÷�Ӧ�ں��º�ѹ�����н���,�ܱ����÷�Ӧ�ﵽƽ��״̬����________(ѡ�����)��
a��c(CH2)=c(CO) b�����������������
c��v(CO)��v(H2)�ı�ֵ���� d����������ƽ����Է�����������
�ܸ÷�Ӧ�Ļ�ѧƽ�ⳣ���ĸ�����pK�淴Ӧ�¶�T�ı仯��������ͼ��

����ƽ���ƶ�ԭ���������ߵı仯����________________����700��ʱ���ƽ��ʱ,H2Ũ��Ϊ1.0mol��L-1,��CH4��ƽ��ת����Ϊ_________��
��2�����������Ҫ�ɷ���FeCO3,ʵ�����п���ͨ��FeSO4������NaHCO3��Һ����Ƶ�FeCO3,�йط�Ӧ�����ӷ���ʽΪ________________________����֪Ksp[FeCO3]=3.2��10-11,H2CO3��Ka1=4.30��10-7,Ka2=5.61��10-11����ͨ���������ݼ�Ҫ����˵���÷�Ӧ�ܽ��е�ԭ��_______________________________��
��3��Na2FeO4��һ�ָ�Ч��ˮ��,��ҵ����FeΪ����,NaOHΪ�������Һ���е���Ʊ�,д�������ĵ缫��Ӧʽ_________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��.̼ԭ����������10�����������У�һ�ȴ���ֻ��һ�ֵ���������
A. 2�� B. 3�� C. 4�� D. 5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2C2O4���Ҷ��������������ᣬ��������Ȼ���ֲ���С���֪�����²������ƽ�ⳣ��K1=5.0��10-2��K2=5.4��10-5��̼��ĵ���ƽ�ⳣ��K1=4.5��10-7��K2=4.7��10-11��Ksp (CaC2O4)=2.3��10-9��Ksp(CaCO3)=2.5��10-9���ش�����������
��1��д��������Һ�д��ڵ���Ҫ���뷴Ӧ����ʽ_____________________________________��
��2�����ڽ������벤�˻��ʳ�ã�������ʧ�����һ�����ʯ������������______________________��
��3��25�������ʵ���Ũ�Ⱦ�Ϊ0.1mol/L ��Na2C2O4��Һ��pH��Na2CO3��ҺpH_________������������ С���������������������������Һ�������Ϻμ�CaCl2��Һ����C2O42- ������ȫʱ��CO32-�Ƿ������ȫ_______________��������������������
��4��д��NaHC2O4��Һ��ˮ�ⷴӦ�����ӷ���ʽ________________________________�����㳣���¸÷�Ӧ��ˮ��ƽ�ⳣ��Ϊ_____________________��NaHC2O4��Һ��pH____7 �����������������=����
��5����ʢ�б��Ͳ�����Һ���Թ��е��뼸�������ữ��KMnO4��Һ����������Һ���Ϻ�ɫ��ȥ��д���÷�Ӧ�����ӷ���ʽ________________________________________��
��6�����ʵ��֤����������Ա�̼��ǿ________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com