
【题目】二甲醚(CH3OCH3)被称为21世纪的新型燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
化学反应方程式 | 化学平衡常数 | |
①CO(g)+2H2(g) | ΔH1=-99 kJmol-1 | K1 |
②2CH3OH(g) | ΔH2=-24 kJmol-1 | K2 |
③CO(g)+H2O(g) | ΔH3=-41 kJmol-1 | K3 |
(1)该工艺的总反应为3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g) ΔH
CH3OCH3(g)+CO2(g) ΔH
该反应ΔH=__________________,化学平衡常数K=____________________(用含K1、K2、K3的代数式表示)。
(2)某温度下,将8.0molH2和4.0molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则CO的转化率为________。
CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则CO的转化率为________。
(3)下列措施中,能提高CH3OCH3产率的有________。
A.分离出二甲醚 B.升高温度 C.改用高效催化剂 D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率,原因是_______________________________。
【答案】 -263 kJmol-1 K12·K2·K3 75% AD 反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率
【解析】(1)根据盖斯定律可知①×2+②+③即得到总反应为3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g)的ΔH=-263 kJmol-1,其化学平衡常数K= K12·K2·K3。
CH3OCH3(g)+CO2(g)的ΔH=-263 kJmol-1,其化学平衡常数K= K12·K2·K3。
(2) 4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
起始量(mol) 8 4 0 0
转化量(mol) 2x x 0.5x 0.5x
平衡量(mol) 8-2x 4-x 0.5x 0.5x
平衡时测得二甲醚的体积分数为25%,则![]() ,解得x=3,所以CO的转化率为3/4×100%=75%;
,解得x=3,所以CO的转化率为3/4×100%=75%;
(3)生成二甲醚的反应是放热的体积减小的可逆反应,所以能提高CH3OCH3产率的措施有分离出二甲醚或降低温度或增大压强,催化剂不能改变平衡状态,答案选AD。
(4)根据方程式可知反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】锌-空气电池由活性炭(空气扩散极)、锌、苛性碱溶液构成,其中活性炭部分浸泡在苛性碱溶液中,其工作原理如图所示,负极产物是ZnO。下列说法正确的是( )

A. 活性炭的作用是吸附空气,为电池提供氧化剂
B. 原理图中的隔离膜为质子交换膜
C. 负极反应式为Zn+H2O-2e-=ZnO+2H+
D. 电池工作时,当电路中通过0.2mol电子,消耗3.2gO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某NaOH固体试样中含有NaCl杂质,为测定NaOH的质量分数,进行了如下实验。
①称量1.00g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加3~4滴酚酞溶液;
④用0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:

请回答:
(1)步骤①中配制溶液时,需要的玻璃仪器除烧杯,胶头滴管,玻璃棒外,还需要 ____________。
(2)用______滴定管(填“酸式”或“碱式”)盛装0.10mol/L的盐酸标准液.
(3)烧碱样品的纯度为_______________。
(4)若出现下列情况,测定结果偏高的是______。
a.滴定前用蒸馏水冲洗锥形瓶
b.盛放标准液滴定管用蒸馏水洗后,未用标准液润洗
c. 若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d. 在振荡锥形瓶时不慎将瓶内溶液溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。查阅资料知:
①Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
②向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3。
③BaSO3难溶于水,可溶于稀HCl。
实验装置如图所示(省略夹持装置)
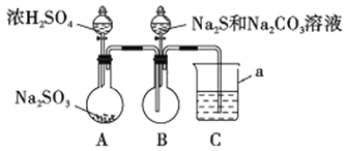
(1)仪器a的名称是_________;C中的试剂可以是______ (选填下列字母编号)。
A.稀H2SO4 B.酸性KMnO4溶液 C.饱和NaHSO3溶液 D.NaOH溶液
(2)此实验装置设计有缺陷,其改进方法是_________________________。
(3)写出B中反应的离子方程式_________________________________________。
(4)A、B中反应完后,在拆装置前,应将其中污染空气的有毒气体除去,采用的方法和具体操作是________________________________________。
(5)该法所得产品中常含有少量Na2SO3和Na2SO4。为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,加足量BaCl2溶液,有白色沉淀生成,_______________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(6)测定产品纯度:准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol/L碘的标准溶液滴定。(反应原理为:2S2O32-+I2=S4O62-+2I-)
①滴定至终点时,溶液颜色的变化是_______________________。
②滴定记录数据如下表:
滴定前读数/mL | 滴定后读数/mL | |
第一次 | 0.10 | 16.12 |
第二次 | 1.10 | 17.08 |
第三次 | 1.45 | 19.45 |
第四次 | 0.00 | 16.00 |
③产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图所示的实验装置进行铁与水蒸气的实验,并研究铁及其化合物的部分性质。

请回答下列问题:
(1)硬质试管中发生反应的化学方程式为______________________。
(2)该同学为确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色,则说明硬质试管的固体物质中一定有____,可能有____;若溶液未变红色,则说明硬质试管中固体物质的成分是____________________。
(3)该同学按(2)中所述实验方案进行了实验,结果溶液未变红色,原因是___________(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其与NaOH溶液反应。若按下图所示操作,可观察到试管中先生成白色沉淀,后沉淀迅速变成灰绿色,最后变成红褐色的现象,请写出白色沉淀变为红褐色的过程中所发生反应的化学方程式:______________________________。

(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+具有____________性。由此可知,实验室中含有Fe2+的盐溶液需现用现配制的原因是____________________,并且配制含Fe2+的盐溶液时应加入少量____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是
A. 甲、乙中都是铝过量 B. 甲中铝过量,乙中碱过量
C. 甲中酸过量,乙中铝过量 D. 甲中酸过量,乙中碱过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学拟用氯化钙固体、碳酸钠溶液和稀硝酸等试剂,先制得碳酸钙,最终制得纯净的硝酸钙晶体。
(1)写出制取过程中反应的离子方程式:________________、________________________。
(2)请帮助该同学完成下列实验操作步骤(不要求回答使用的仪器)
①用蒸馏水完全溶解CaCl2后,加入________。
②将反应后的混合物过滤,并用适量蒸馏水洗涤沉淀至无Cl-。
③加入________________,使沉淀完全溶解。
④将所得溶液蒸发、结晶,得到纯净的硝酸钙晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的有机原料,在催化剂的作用下,CO和H2反应可生成甲醇 (CH3OH) 和副产物CH4,反应如下:
反应①CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.0kJ/mol
CH3OH(g) △H1=-90.0kJ/mol
反 应②CO(g)+3H2(g)![]() CH4(g) + H2O(g) △H2
CH4(g) + H2O(g) △H2
反应③ CH4(g)+2H2O(g)![]() CO2(g)+ 4H2(g) △H3=+125.0 kJ/mol
CO2(g)+ 4H2(g) △H3=+125.0 kJ/mol
反应④CO(g)+ H2O(g)![]() CO2(g) + H2(g) △H4=-25.0 kJ /mol
CO2(g) + H2(g) △H4=-25.0 kJ /mol
K1、K2、K3、K4分别表示反应①、②、③、④的平衡常数。
回答下列问题:
(1)反应②的平衡常数的表达式为K2=______________,K2与K3和K4的关系为K2=______________,△H2=____________kJ/mol。
(2)图1中能正确表示反应①的平衡常数(lgK1) 随温度变化的曲线为______________(填曲线字母),其判断理由为______________________________________________________________。

(3)恒温恒容的条件下,下列情况能说明反应①达到平衡状态的是__________________。
A.2v正 (H2)=v逆(CH3OH) B.混合气体的密度不再改变
C.混合气体的平均摩尔质量不再改变 D.混合气体的压强不再改变
(4)为探究不同催化剂对CO和H2生成CH3OH的选择性效果,某实验室控制CO和H2的初始投料比为1∶3进行实验,得到如下数据:
T/K | 时间/min | 催化剂种类 | 甲醇的含量(%) |
450 | 10 | CuO-ZnO | 78 |
450 | 10 | CuO-ZnO-ZrO2 | 88 |
450 | 10 | ZnO-ZrO2 | 46 |

①由表1可知,反应①的最佳催化剂为______________,图2中a、b、c、d四点是该温度下CO平衡转化率的是_________________________________。
②有利于提高CO转化为CH3OH的平衡转化率的措施有_________________。
A.使用催化剂CuO-ZnO-ZrO2 B.适当降低反应温度
C.增大CO和H2的初始投料比 D.恒容下,再充入a molCO和3a mol H2
(5)已知1000℃,反应CO(g)+ H2O(g)![]() CO2(g) + H2(g) K4=1.0。该温度下,在某时刻体系中CO、H2O、CO2、H2的浓度分别为3molL-1、1molL-1、4molL-1、2molL-1,则此时上述反应的v正(CO)_______v逆(CO) (填“>”、“<”或“=”)达到平衡时c(CO)=___________ molL-1。
CO2(g) + H2(g) K4=1.0。该温度下,在某时刻体系中CO、H2O、CO2、H2的浓度分别为3molL-1、1molL-1、4molL-1、2molL-1,则此时上述反应的v正(CO)_______v逆(CO) (填“>”、“<”或“=”)达到平衡时c(CO)=___________ molL-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com