
【题目】若向25mLNaOH溶液中逐滴加入0.2mol/LCH3COOH溶液过程中溶液pH的变化曲线如图所示。

(1)该NaOH溶液的物质的量浓度为_________________。
(2)a____12.5mL(填“>”,“<”或“=”),若由体积相等的氢氧化钠和醋酸溶液混合而且恰好呈中性
(3)在D点溶液中各离子浓度由大到小顺序为_____________________ .
【答案】 0.1mol·L-1 > c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
【解析】(1)由图像可知:NaOH溶液的pH=13,c(H+)=10-13,c(OH-)=10-1 mol·L-1= c(NaOH);正确答案:0.1mol·L-1。
(2)25mL、0.1mol·L-1 NaOH溶液与12.5mL、0.2mol/LCH3COOH溶液恰好完全反应生成醋酸钠溶液,溶液显碱性;若要呈中性,醋酸就得稍过量,所以a>12.5ml;正确答案:>;
(3)25mL、0.1mol·L-1 NaOH溶液与25mL、0.2mol/LCH3COOH溶液完全反应,混合液为醋酸钠和醋酸(1:1),溶液显酸性;醋酸的电离过程大于醋酸钠的水解过程,溶液中离子浓度大小关系:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);正确答案:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】用高能2612Mg核轰击24896Cm核,发生核合成反应,得到新原子269108Hs,该原子中中子数与核外电子数之差为( )
A. 161 B. 108 C. 84 D. 53
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图:已知A为单质且与盐酸反应生成B和氢气,D也为单质。根据上图回答下列问题:

(1)C的化学式为_______
(2)B+D→C的化学方程式为_________
(3)B与氨水反应的现象为__________
(4)请写出该现象对应的所有离子反应方程式_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol·L-1NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)下列操作中,容量瓶所不具备的功能有________(填序号)。

A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.1 mol·L-1(填“大于”“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时未经冷却,则所得溶液浓度________0.1 mol·L-1。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述中,正确的是( )
A.一定有氧元素参加
B.氧化剂本身发生氧化反应
C.氧化反应一定先于还原反应发生
D.一定有电子转移(得失或偏移)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某NaOH固体试样中含有NaCl杂质,为测定NaOH的质量分数,进行了如下实验。
①称量1.00g样品溶于水,配成250mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加3~4滴酚酞溶液;
④用0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:

请回答:
(1)步骤①中配制溶液时,需要的玻璃仪器除烧杯,胶头滴管,玻璃棒外,还需要 ____________。
(2)用______滴定管(填“酸式”或“碱式”)盛装0.10mol/L的盐酸标准液.
(3)烧碱样品的纯度为_______________。
(4)若出现下列情况,测定结果偏高的是______。
a.滴定前用蒸馏水冲洗锥形瓶
b.盛放标准液滴定管用蒸馏水洗后,未用标准液润洗
c. 若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d. 在振荡锥形瓶时不慎将瓶内溶液溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年中科院大连化物所包信和团队研究甲烷高效转化获重大突破。催化原理如图所示,该研究彻底摒弃了高耗能的合成气制备过程,大大缩短了工艺路线,反应过程本身实现了二氧化碳的零排放,碳原子利用效率达到100%。关于该反应的下列说法错误的是

A. 催化剂降低了反应的活化能 B. CH4→CH3+H的过程需要吸收能量
C. 该反应符合绿色化学原理 D. CH3 是稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。查阅资料知:
①Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
②向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3。
③BaSO3难溶于水,可溶于稀HCl。
实验装置如图所示(省略夹持装置)
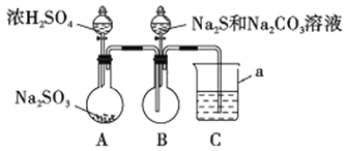
(1)仪器a的名称是_________;C中的试剂可以是______ (选填下列字母编号)。
A.稀H2SO4 B.酸性KMnO4溶液 C.饱和NaHSO3溶液 D.NaOH溶液
(2)此实验装置设计有缺陷,其改进方法是_________________________。
(3)写出B中反应的离子方程式_________________________________________。
(4)A、B中反应完后,在拆装置前,应将其中污染空气的有毒气体除去,采用的方法和具体操作是________________________________________。
(5)该法所得产品中常含有少量Na2SO3和Na2SO4。为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,加足量BaCl2溶液,有白色沉淀生成,_______________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(6)测定产品纯度:准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol/L碘的标准溶液滴定。(反应原理为:2S2O32-+I2=S4O62-+2I-)
①滴定至终点时,溶液颜色的变化是_______________________。
②滴定记录数据如下表:
滴定前读数/mL | 滴定后读数/mL | |
第一次 | 0.10 | 16.12 |
第二次 | 1.10 | 17.08 |
第三次 | 1.45 | 19.45 |
第四次 | 0.00 | 16.00 |
③产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com