
【题目】下列关于浓硫酸的说法不正确的是
A.能干燥氯气
B.具有强腐蚀性
C.可与金属反应制取氢气
D.加热时能与木炭发生反应
科目:高中化学 来源: 题型:
【题目】甲、乙是元素周期表中同一周期IIA和IIIA的两种元素,若甲的原子序数为X,则乙的原子序数不可能是( )
A. X+1B. X+13C. X+11D. X+25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国早期科技丛书《物理小识·金石类》写到:“青矾厂气熏人,衣服当之易烂,载木不盛,惟乌柏树不畏其气”,“青矾”则是绿矾,强热时发生如下反应:
2FeSO4·7H2O→Fe2O3+SO3+SO2+7H2O
回答下列问题:
(1)基态硫原子的价层电子排布式___________,其最高能级上电子云形状是___________,上述四种元素电负性由大到小的顺序是___________,从结构的角度解释Fe3+稳定性强于Fe2+的原因是__________。
(2)氧、硫能形成许多化合物,如:H2O、SO2、SO3、SO42-,这些物质的中心原子杂化轨道类型为SP2的是___________,空间构型是V形的分子是___________,属于非极性分子的是___________。
(3)已知Fe2O3熔点为1565℃,在熔化状态下液体中存在两种粒子,则其晶体类型最可能是___________,若FeO与Fe2O3晶体类型相同,则二者熔点较高的物质是___________。
(4)铁的某种氧化物晶胞如图所示(实心球为铁原子);
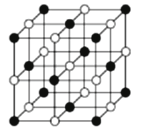
①该氧化物的化学式为___________。
②氧、铁的原子半径分别为rO pm、rFe pm,晶体密度为ρg·cm-3,阿伏伽德罗常数的值为NA,该晶胞的空间利用率为___________(用含π的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】印刷电路板是由有机复合材料和铜箔复合构成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,研究其制备及性质是一个重要的课题。
(1)氯化铁晶体的制备(夹持及加热装置省略)
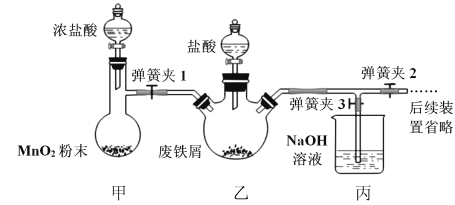
①实验过程中装置甲中发生反应的离子方程式_________________________________。
②为顺利达成实验目的,上述装置中甲中活塞、乙中活塞、弹簧夹1、2、3打开和关闭的顺序为__________。
③反应结束后,将乙中溶液边加入___________,边进行加热浓缩、___________、过滤、洗涤、干燥即得到产品。
(2)氯化铁的性质探究:
已知:①氯化铁的熔点为306℃、沸点为315℃,易升华,气态FeCl3会分解成FeCl2和Cl2②FeCl2熔点670℃)

操作步骤 | 实验现象 | 解释原因 |
打开K,充入氮气 | D中有气泡产生 | ①充入N2的原因___________ |
关闭K,加热至600℃,充分灼烧固体 | B中出现棕黄色固体 | ②产生现象的原因___________。 |
实验结束,振荡C静置 | ③___________ | ④___________(用方程式解释) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是:( )
①金属钠、氢气都能在氯气中燃烧,生成白色的烟雾;②铜丝在氯气中燃烧,生成蓝绿色的氯化铜;③液氯就是氯气的水溶液,它能使干燥的有色布条褪色;④久置的氯水,因氯气几乎完全挥发掉,剩下的就是水
A.①B.①②C.①③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物M的合成路线如下图所示:

已知:ⅰ.RCH2Br![]() R—HC=CH—R'
R—HC=CH—R'
ⅱ.R—HC=CH—R'![]()
![]()
ⅲ.R—HC=CH—R'![]()
![]() (以上R、R'、R″代表氢、烷基或芳基等)
(以上R、R'、R″代表氢、烷基或芳基等)
(1)D中官能团名称为_____,A的化学名称为_____。
(2)F的结构简式为_____,则与F具有相同官能团的同分异构体共_____种(考虑顺反异构,不包含F)。
(3)由G生成H的化学方程式为_____,反应类型为_____。
(4)下列说法不正确的是_____(选填字母序号)。
a.可用硝酸银溶液鉴别B、C两种物质
b.由H生成M的反应是加成反应
c.1 mol E最多可以与4 mol H2发生加成反应
d.1 mol M与足量NaOH溶液反应,消耗4 mol NaOH
(5)以乙烯为起始原料,结合已知信息选用必要的无机试剂,写出合成![]() 的路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。__________
的路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态溴原子的价层电子轨道排布式为________。第四周期中,与溴原子未成对电子数相同的金属元素有_______种。
(2)铍与铝的元素性质相似。下列有关铍和铝的叙述正确的有___________(填标号)。
A.都属于p区主族元素B.电负性都比镁大
C.第一电离能都比镁大D.氯化物的水溶液pH均小于7
(3)Al元素可形成[AlF6]3-、[AlCl4]-配离子,而B元素只能形成[BF4]-配离子,由此可知决定配合物中配位数多少的因素是________________;[AlCl4]-的立体构型名称为______。
(4)P元素有白磷、红磷、黑磷三种常见的单质。
①白磷(P4)易溶于CS2,难溶于水,原因是________________
②黑磷是一种黑色有金属光泽的晶体,是一种比石墨烯更优秀的新型材料。白磷、红磷都是分子晶体,黑磷晶体与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是_________。

A.黑磷晶体中磷原子杂化方式为sp2杂化
B.黑磷晶体中层与层之间的作用力是分子间作用力
C.黑磷晶体的每一层中磷原子都在同一平面上
D.P元素三种常见的单质中,黑磷的熔沸点最高
(5)F2中F-F键的键能(157kJ/mol)小于Cl2中Cl-Cl键的键能(242.7kJ/mol),原因是_________。
(6)金属钾的晶胞结构如图。若该晶胞的密度为a g/cm3,阿伏加得罗常数为NA,则表示K原子半径的计算式为______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com