
【题目】具有抗菌作用的白头翁素衍生物M的合成路线如下图所示:

已知:ⅰ.RCH2Br![]() R—HC=CH—R'
R—HC=CH—R'
ⅱ.R—HC=CH—R'![]()
![]()
ⅲ.R—HC=CH—R'![]()
![]() (以上R、R'、R″代表氢、烷基或芳基等)
(以上R、R'、R″代表氢、烷基或芳基等)
(1)D中官能团名称为_____,A的化学名称为_____。
(2)F的结构简式为_____,则与F具有相同官能团的同分异构体共_____种(考虑顺反异构,不包含F)。
(3)由G生成H的化学方程式为_____,反应类型为_____。
(4)下列说法不正确的是_____(选填字母序号)。
a.可用硝酸银溶液鉴别B、C两种物质
b.由H生成M的反应是加成反应
c.1 mol E最多可以与4 mol H2发生加成反应
d.1 mol M与足量NaOH溶液反应,消耗4 mol NaOH
(5)以乙烯为起始原料,结合已知信息选用必要的无机试剂,写出合成![]() 的路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。__________
的路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。__________
【答案】 溴原子、酯基 邻二甲苯(或1,2—二甲基苯) ![]() 5
5 ![]() +NaOH
+NaOH ![]()
![]() +NaI+H2O 消去反应 ad
+NaI+H2O 消去反应 ad 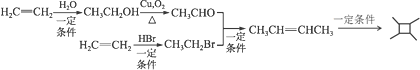
【解析】试题分析:本题考查有机推断和有机合成。主要考查官能团的识别,有机物的命名,有机物结构简式和化学方程式的书写,有机物的性质,限定条件同分异构体种类的确定,有机合成路线的设计。A的分子式为C8H10,A的不饱和度为4,A氧化生成B(C8H8O2),B发生取代反应生成C(![]() ),逆推出A的结构简式为
),逆推出A的结构简式为![]() ,B的结构简式为
,B的结构简式为![]() ;C与CH3OH在浓硫酸并加热时反应生成D,根据D的分子式知此步骤为酯化反应,D的结构简式为
;C与CH3OH在浓硫酸并加热时反应生成D,根据D的分子式知此步骤为酯化反应,D的结构简式为![]() ;D+HCHO→E发生题给已知i的反应;E中含酯基,E在NaOH溶液中发生水解,酸化后生成F,F的结构简式为
;D+HCHO→E发生题给已知i的反应;E中含酯基,E在NaOH溶液中发生水解,酸化后生成F,F的结构简式为![]() ;F中含碳碳双键和羧基,根据F→G的条件和G的分子式,F→G发生题给已知ii的反应,G在NaOH的醇溶液中发生消去反应生成H,H→M发生题给已知iii的反应,根据M的结构简式可逆推出:G的结构简式为
;F中含碳碳双键和羧基,根据F→G的条件和G的分子式,F→G发生题给已知ii的反应,G在NaOH的醇溶液中发生消去反应生成H,H→M发生题给已知iii的反应,根据M的结构简式可逆推出:G的结构简式为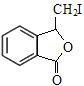 ,H的结构简式为
,H的结构简式为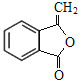 。
。
(1)D的结构简式为![]() ,D中官能团名称为溴原子、酯基。A的结构简式为
,D中官能团名称为溴原子、酯基。A的结构简式为![]() ,A的名称为邻二甲苯或1,2-二甲基苯。
,A的名称为邻二甲苯或1,2-二甲基苯。
(2)F的结构简式为![]() 。F中的官能团为碳碳双键和羧基,与F具有相同官能团的同分异构体有
。F中的官能团为碳碳双键和羧基,与F具有相同官能团的同分异构体有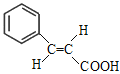 、
、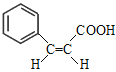 、
、![]() 、
、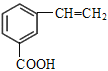 、
、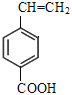 ,共5种。
,共5种。
(3)由G生成H的化学方程式为 +NaOH
+NaOH![]()
 +NaI+H2O。反应类型为消去反应。
+NaI+H2O。反应类型为消去反应。
(4)a,B的结构简式为![]() ,C的结构简式为
,C的结构简式为![]() ,B、C都不能与AgNO3溶液反应,不能只用AgNO3溶液鉴别,应用NaOH溶液、稀HNO3和AgNO3溶液鉴别,a项错误;b,H生成M发生题给已知iii的反应,该反应的反应类型是加成反应,b项正确;c,E的结构简式为
,B、C都不能与AgNO3溶液反应,不能只用AgNO3溶液鉴别,应用NaOH溶液、稀HNO3和AgNO3溶液鉴别,a项错误;b,H生成M发生题给已知iii的反应,该反应的反应类型是加成反应,b项正确;c,E的结构简式为![]() ,E中的苯环和碳碳双键能与H2发生加成反应,1molE最多可以与4molH2发生加成反应,c项正确;d,M中含2个酯基,1molM与足量NaOH溶液反应,消耗2molNaOH,d项错误;答案选ad。
,E中的苯环和碳碳双键能与H2发生加成反应,1molE最多可以与4molH2发生加成反应,c项正确;d,M中含2个酯基,1molM与足量NaOH溶液反应,消耗2molNaOH,d项错误;答案选ad。
(5)观察![]() 的结构,结合题给已知iii,合成
的结构,结合题给已知iii,合成![]() 先合成CH3CH=CHCH3;对比CH3CH=CHCH3和CH2=CH2的结构简式,碳链增长,结合题给已知i,由乙烯先合成CH3CH2Br、CH3CHO;联系课本官能团之间的相互转化,由乙烯与HBr加成合成CH3CH2Br,乙烯与水发生加成反应生成CH3CH2OH,CH3CH2OH发生催化氧化生成CH3CHO。合成路线为:
先合成CH3CH=CHCH3;对比CH3CH=CHCH3和CH2=CH2的结构简式,碳链增长,结合题给已知i,由乙烯先合成CH3CH2Br、CH3CHO;联系课本官能团之间的相互转化,由乙烯与HBr加成合成CH3CH2Br,乙烯与水发生加成反应生成CH3CH2OH,CH3CH2OH发生催化氧化生成CH3CHO。合成路线为: 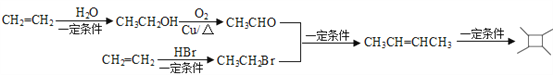 。
。


科目:高中化学 来源: 题型:
【题目】下列有关钠的叙述正确的是( )
①钠在空气中燃烧生成氧化钠 ②金属钠可以保存在煤油中
③钠与硫酸铜溶液反应,可以置换出铜 ④金属钠有强还原性
⑤钠原子的最外层上只有一个电子,所以在化合物中钠的化合价显+1价
A.①②④B.②③⑤C.①④⑤D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)三氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示:
①此配合物中,铁离子价电子排布图为_____;
②此配离子中碳原子的杂化轨道类型为_____;
③此配离子中含有的化学键为_____。
A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键 G.σ键 H.π键
(2)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。NO2-离子的VSEPR模型名称为_____,K3[Co(NO2)6]是黄色沉淀,该物质中四种元素的电负性由大到小的顺序是_____。
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2,其中适合作录音带磁粉原料的是_____。

(4)锰的一种配合物的化学式为Mn(BH4)2(THF)3,写出两种与BH4-互为等电子体的微粒_____(请写一个分子和一个离子)。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶体的结构如图所示,a的配位数为_____,已知晶胞密度为ρ g/cm3,则相邻2个b微粒之间的距离为_____nm(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式,书写正确的是( )
A.澄清石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H2O
B.稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑
C.硝酸银溶液中加入铜粉:2Ag++Cu═Cu2++2Ag↓
D.盐酸跟氢氧化镁反应:H++OH﹣═H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某燃料电池如图所示,两电极A、B材料都是石墨,下列说法不正确的是

A. 氧气在正极发生还原反应
B. 若电解质为氢氧化钠溶液,则负极反应式为 H2-2e-+2OH-=2H2O
C. 电子由电极a流经电解液到电极b
D. 若正极消耗的气体质量为4 g,则转移的电子的物质的量为0.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化钴(Co2O3)粉体材料在工业、电子、电讯等领域都有着广阔的应用前景。某铜钴矿石主要含有CoO(OH) 、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺过程如下:
Ⅰ.将粉碎的矿石用过量的稀H2SO4和Na2SO3溶液浸泡。
Ⅱ.浸出液除去含铜的化合物后,向溶液中先加入NaClO3溶液,再加入一定浓度的Na2CO3溶液,过滤,分离除去沉淀a [主要成分是Na2Fe6(SO4)4(OH)12]。
Ⅲ.向上述滤液中加入足量NaF溶液,过滤,分离除去沉淀b。
Ⅳ.Ⅲ中滤液加入浓Na2CO3溶液,获得CoCO3沉淀。
V.将CoCO3溶解在盐酸中,再加入(NH4)2C2O4溶液,产生 CoC2O4·2H2O沉淀。分离出沉淀,将其在400 ℃~600 ℃煅烧,即得到Co2O3。
请回答:
(1)Ⅰ中,稀硫酸溶解CoCO3的化学方程式是________,加入Na2SO3溶液的主要作用是________。
(2)根据图1、图2分析:

①矿石粉末浸泡的适宜条件应是________。
②图2中铜、钴浸出率下降的可能原因是________。
(3)Ⅱ中,浸出液中的金属离子与NaClO3反应的离子方程式:ClO3 + + == Cl + + __________ ,________________
(4)Ⅱ中,检验铁元素完全除去的试剂是________,实验现象是________。
(5)Ⅱ、Ⅳ中,加入Na2CO3 的作用分别是________、________。
(6)Ⅲ中,沉淀b的成分是MgF2 、________(填化学式)。
(7)Ⅴ中,分离出纯净的CoC2O4·2H2O的操作是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) △H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器中进行以上的反应(此条件下为可逆反应),下列叙述正确的是
Si(s)+4HCl(g) △H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器中进行以上的反应(此条件下为可逆反应),下列叙述正确的是
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C. 反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min
D. 当反应吸热为0.025QkJ时,生成的HCl与100mL1mol·L-1的NaOH溶液恰好反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com