
【题目】金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)三氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示:
①此配合物中,铁离子价电子排布图为_____;
②此配离子中碳原子的杂化轨道类型为_____;
③此配离子中含有的化学键为_____。
A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键 G.σ键 H.π键
(2)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。NO2-离子的VSEPR模型名称为_____,K3[Co(NO2)6]是黄色沉淀,该物质中四种元素的电负性由大到小的顺序是_____。
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2,其中适合作录音带磁粉原料的是_____。

(4)锰的一种配合物的化学式为Mn(BH4)2(THF)3,写出两种与BH4-互为等电子体的微粒_____(请写一个分子和一个离子)。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶体的结构如图所示,a的配位数为_____,已知晶胞密度为ρ g/cm3,则相邻2个b微粒之间的距离为_____nm(列计算式)。
【答案】 ![]() sp2、sp3 C D E G H 平面三角形 O>N>Co>K CrO2 CH4(SiH4)、NH4+ 4
sp2、sp3 C D E G H 平面三角形 O>N>Co>K CrO2 CH4(SiH4)、NH4+ 4 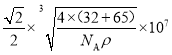 (或
(或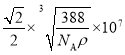 )
)
【解析】试题分析:本题考查物质结构与性质,主要考查价电子排布图的书写,电负性的比较,杂化方式和VSEPR模型的判断,化学键的类型,等电子体的书写,配位数的确定,晶体的计算。
(1)①铁的原子序数为26,基态铁原子核外电子数为26,根据构造原理,基态铁原子的核外电子排布式为[Ar]3d64s2,则Fe3+的核外电子排布式为[Ar]3d5,Fe3+的价电子排布式为3d5,Fe3+的价电子排布式图为![]() 。
。
②此配离子中-C2H5和-CH3中碳原子为sp3杂化,“C=O”和“C=C”中碳原子为sp2杂化,此配离子中碳原子的杂化类型为sp3杂化、sp2杂化。
③根据配离子的结构知,乙酰乙酸乙酯中碳碳之间存在非极性键,碳氢、碳氧、氧氢之间存在极性键,单键中只有σ键,碳碳双键和碳氧双键中存在σ键和π键,Fe3+与乙酰乙酸乙酯之间存在配位键,此配离子中含有的化学键为极性键、非极性键、配位键、σ键和π键,答案选CDEGH。
(2)NO2-中中心原子N的孤电子对数为![]() (5+1-2
(5+1-2![]() 2)=1,成键电子对数为2,价层电子对数为1+2=3,NO2-的VSEPR模型为平面三角形。元素的非金属性越强电负性越大,元素的金属性越强电负性越小,则四种元素的电负性由大到小的顺序为O
2)=1,成键电子对数为2,价层电子对数为1+2=3,NO2-的VSEPR模型为平面三角形。元素的非金属性越强电负性越大,元素的金属性越强电负性越小,则四种元素的电负性由大到小的顺序为O![]() N
N![]() Co
Co![]() K。
K。
(3)V2O5中金属阳离子为V5+,V5+的核外电子排布式为1s22s22p63s23p6,没有未成对电子;CrO2中金属阳离子为Cr4+,Cr4+的核外电子排布式为1s22s22p63s23p63d2,3d上有2个未成对电子;根据“金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好”,适合作录音带磁粉原料的是CrO2。
(4)用替换法,与BH4-互为等电子体的分子为CH4、SiH4,离子为NH4+等。
(5)由晶胞可见b的配位数为4,该晶体的化学式为ZnS,则a的配位数也为4。用“均摊法”,晶胞中含a:8![]() +6
+6![]() =4,含b:4,设晶胞的边长为x,则晶胞的体积为x3,1mol晶体的体积为
=4,含b:4,设晶胞的边长为x,则晶胞的体积为x3,1mol晶体的体积为![]() NA,1mol晶体的质量为(32+65)g=97g,1mol晶体的体积为
NA,1mol晶体的质量为(32+65)g=97g,1mol晶体的体积为![]() ,
, ![]() NA=
NA=![]() ,解得x=
,解得x=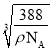 cm。根据晶胞相邻2个b微粒之间的距离为面对角线的一半,相邻2个b微粒之间的距离为
cm。根据晶胞相邻2个b微粒之间的距离为面对角线的一半,相邻2个b微粒之间的距离为![]() x=
x=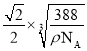 cm=
cm=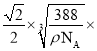 107nm。
107nm。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是 ( )
A. 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O![]() NH4++OH
NH4++OH
B. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
C. 由Na和C1形成离子键的过程:![]()
D. 电解精炼铜的阴极反应:Cu2++2e=Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,按酸、碱、盐、碱性氧化物、酸性氧化物的顺序排列正确的是( )
A.盐酸、纯碱、氯酸钾、氧化镁、二氧化硅
B.硝酸、烧碱、纯碱、氧化钙、二氧化硫
C.碳酸、消石灰、硫酸铵、一氧化碳、三氧化硫
D.醋酸、烧碱、生石灰、氧化铁、二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组的同学为探究原电池原理,设计如图所示装置,将锌、铜通过导线相连,置于稀硫酸中。

(1)外电路,电子从__________极流出。溶液中,阳离子向_______极移动。
(2)若反应过程中有0.2 mol电子发生转移,则生成的气体在标准状况下的体积为______________。
(3)该小组同学将稀硫酸分别换成下列试剂,电流计仍会偏转的是_____(填序号)。
A.无水乙醇 B.醋酸溶液 C.CuSO4溶液 D.苯
(4)实验后同学们经过充分讨论,认为符合某些要求的化学反应都可以通过原电池来实现。下列反应可以设计成原电池的是____________(填字母代号)。
A. NaOH+HCl=NaCl+H2O B. 2H2+O2=2H2O
C. Fe+2FeCl3=3FeCl2 D. 2H2O=2H2↑+2O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气(主要成分为NOx和CO)已成为主要的空气污染物来源之一,有发生光化学烟雾污染的潜在危险。
(1)某小组同学为研究光化学烟雾的形成进行了模拟实验。测得烟雾的主要成分为CxHy(烃)、NO、NO2、O3、PAN (CH3COOONO2),各种物质的相对浓度随时间的变化如右图。根据图中数据,下列推论最不合理的是_____。(填选项序号字母)

a.NO的消失的速率比CxHy快 b.NO生成NO2
c.CxHy及NO2可以生成PAN及O3 d.O3生成PAN
(2)一定条件下,将2 mol NO与2 mol O2置于恒容密闭容器中发生反应2NO(g)+O2(g) ![]() 2NO2(g),下列可判断反应达平衡的是_____。(填选项序号字母)
2NO2(g),下列可判断反应达平衡的是_____。(填选项序号字母)
a.体系压强保持不变 b.混合气体密度保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗2 mol NO同时生成2 mol NO2
(3)高温下N2和O2发生N2(g)+O2(g)![]() 2NO(g)反应,是导致汽车尾气中含有NO的原因之一。
2NO(g)反应,是导致汽车尾气中含有NO的原因之一。
①右图是T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图像,据此判断反应N2(g)+O2(g)![]() 2NO(g)为_____(填“吸热”或“放热”)反应。
2NO(g)为_____(填“吸热”或“放热”)反应。

②2000℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则此刻反应的平衡常数K=_____。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为_____。

③汽车净化装置里装有含Pd化合物的催化剂,气体在催化剂表面吸附与解吸作用的机理如右图所示。写出其变化的总化学反应方程式:_____。
(4)为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氮氧化物的污染。
例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
若16 g CH4还原NO2至N2,共放出热量867 kJ,则ΔH2=_____。若用标准状况下4.48 L CH4还原NO2至N2,共转移的电子总数为_____(阿伏加德罗常数的值用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物M的合成路线如下图所示:

已知:ⅰ.RCH2Br![]() R—HC=CH—R'
R—HC=CH—R'
ⅱ.R—HC=CH—R'![]()
![]()
ⅲ.R—HC=CH—R'![]()
![]() (以上R、R'、R″代表氢、烷基或芳基等)
(以上R、R'、R″代表氢、烷基或芳基等)
(1)D中官能团名称为_____,A的化学名称为_____。
(2)F的结构简式为_____,则与F具有相同官能团的同分异构体共_____种(考虑顺反异构,不包含F)。
(3)由G生成H的化学方程式为_____,反应类型为_____。
(4)下列说法不正确的是_____(选填字母序号)。
a.可用硝酸银溶液鉴别B、C两种物质
b.由H生成M的反应是加成反应
c.1 mol E最多可以与4 mol H2发生加成反应
d.1 mol M与足量NaOH溶液反应,消耗4 mol NaOH
(5)以乙烯为起始原料,结合已知信息选用必要的无机试剂,写出合成![]() 的路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。__________
的路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体和溶液的说法中,正确的是( )
A.胶体粒子的直径大于100nm
B.用过滤的方法可以分离胶体和溶液
C.光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应
D.将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明溶液,在酸性环境下能大量共存的离子组是( )
A.Na+、SO42-、CO32-、Cl-
B.Mg2+、Cl-、Na+、NO3-
C.K+、MnO4-、NO3-、Fe2+
D.Cu2+、Cl-、H+、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com