
【题目】某无色透明溶液,在酸性环境下能大量共存的离子组是( )
A.Na+、SO42-、CO32-、Cl-
B.Mg2+、Cl-、Na+、NO3-
C.K+、MnO4-、NO3-、Fe2+
D.Cu2+、Cl-、H+、SO42-
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】已知pC=-lgc;Ksp[Cu(OH)2]=2.2×10-20和Ksp[Mg(OH)2]=1.8×10-11,测得两种金属离子的PC与pH的变化关系如下图所示。下列说法正确的是

A. 加入氨水调节pH可除去MgS04溶液中的CuSO4杂质
B. pH调到Q点则Mg2+和Cu2+都已沉淀完全
C. 在浓度均为1mo/LCuSO4和MgS04的混合溶液中,存在c(Cu2+)+c(Mg2+)>c(S042-)
D. L1代表pC(Cu2+)随pH变化,L2代表pC(Mg2+)随pH变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)三氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示:
①此配合物中,铁离子价电子排布图为_____;
②此配离子中碳原子的杂化轨道类型为_____;
③此配离子中含有的化学键为_____。
A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键 G.σ键 H.π键
(2)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。NO2-离子的VSEPR模型名称为_____,K3[Co(NO2)6]是黄色沉淀,该物质中四种元素的电负性由大到小的顺序是_____。
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2,其中适合作录音带磁粉原料的是_____。

(4)锰的一种配合物的化学式为Mn(BH4)2(THF)3,写出两种与BH4-互为等电子体的微粒_____(请写一个分子和一个离子)。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶体的结构如图所示,a的配位数为_____,已知晶胞密度为ρ g/cm3,则相邻2个b微粒之间的距离为_____nm(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某燃料电池如图所示,两电极A、B材料都是石墨,下列说法不正确的是

A. 氧气在正极发生还原反应
B. 若电解质为氢氧化钠溶液,则负极反应式为 H2-2e-+2OH-=2H2O
C. 电子由电极a流经电解液到电极b
D. 若正极消耗的气体质量为4 g,则转移的电子的物质的量为0.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验某溶液中是否含有Na+、K+、Fe3+、Mg2+、Cl-、I-、CO32-、SO42-,限用试剂有:盐酸、硫酸、硝酸钡溶液、硝酸银溶液。设计如下实验步骤,并记录相关现象:
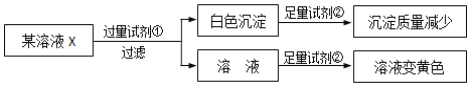
(已知,NO3-在酸性条件下具有强氧化性)
下列叙述不正确的是
A. 试剂①为硝酸钡
B. 试剂②一定为盐酸
C. 该溶被中一定有I-、CO32-、SO42-;Na+、K+至少含有一种
D. 通过在黄色溶液中加入硝酸银可以检验原溶液中是否存在C1-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化钴(Co2O3)粉体材料在工业、电子、电讯等领域都有着广阔的应用前景。某铜钴矿石主要含有CoO(OH) 、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺过程如下:
Ⅰ.将粉碎的矿石用过量的稀H2SO4和Na2SO3溶液浸泡。
Ⅱ.浸出液除去含铜的化合物后,向溶液中先加入NaClO3溶液,再加入一定浓度的Na2CO3溶液,过滤,分离除去沉淀a [主要成分是Na2Fe6(SO4)4(OH)12]。
Ⅲ.向上述滤液中加入足量NaF溶液,过滤,分离除去沉淀b。
Ⅳ.Ⅲ中滤液加入浓Na2CO3溶液,获得CoCO3沉淀。
V.将CoCO3溶解在盐酸中,再加入(NH4)2C2O4溶液,产生 CoC2O4·2H2O沉淀。分离出沉淀,将其在400 ℃~600 ℃煅烧,即得到Co2O3。
请回答:
(1)Ⅰ中,稀硫酸溶解CoCO3的化学方程式是________,加入Na2SO3溶液的主要作用是________。
(2)根据图1、图2分析:

①矿石粉末浸泡的适宜条件应是________。
②图2中铜、钴浸出率下降的可能原因是________。
(3)Ⅱ中,浸出液中的金属离子与NaClO3反应的离子方程式:ClO3 + + == Cl + + __________ ,________________
(4)Ⅱ中,检验铁元素完全除去的试剂是________,实验现象是________。
(5)Ⅱ、Ⅳ中,加入Na2CO3 的作用分别是________、________。
(6)Ⅲ中,沉淀b的成分是MgF2 、________(填化学式)。
(7)Ⅴ中,分离出纯净的CoC2O4·2H2O的操作是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学进行实验研究FeCl3溶液和Na2S溶液的反应。
【实验一】

已知:FeS、Fe2S3均为黑色固体,均能溶于盐酸。H2S气体有臭鸡蛋气味。
同学们对黑色沉淀的成分提出两种假设:
ⅰ.Fe3+与S2反应直接生成沉淀Fe2S3。ⅱ.Fe3+被S2还原,生成沉淀FeS和S。
甲同学进行如下实验:
操作 | 现象 |
取少量FeS固体,加入稀盐酸 | 固体溶解,有臭鸡蛋气味气体生成 |
取少量Fe2S3固体,加入稀盐酸 | 固体溶解,出现淡黄色浑浊,有臭鸡蛋气味气体生成 |
根据上述实验现象和资料,甲得出结论:黑色沉淀是Fe2S3。
(1)0.1 mol·L 1 Na2S溶液的pH为12.5。用离子方程式表示其显碱性的原因:_______。
(2)乙认为甲的结论不严谨,理由是________。
(3)进一步研究证实,黑色沉淀的主要成分是Fe2S3。Na2S溶液呈碱性,FeCl3溶液与其反应不生成Fe(OH)3而生成Fe2S3的可能原因是________。
【实验二】
步骤 | 操作 | 现象 |
I |
| 开始时,局部产生少量的黑色沉淀,振荡,黑色沉淀立即消失,同时溶液中产生淡黄色浑浊和臭鸡蛋气味的气体 |
II | 继续滴加Na2S溶液 | 一段时间后,产生大量的黑色沉淀,振荡,沉淀不消失 |
(4)进一步实验证实,步骤 I 中局部产生少量的黑色沉淀是Fe2S3,黑色沉淀溶解的主要原因不是Fe2S3与溶液中Fe3+发生氧化还原反应。步骤 I 中黑色沉淀溶解的反应的离子方程式是________。
(5)根据以上研究,FeCl3溶液和Na2S溶液反应的产物与________相关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g)。平衡常数如下表:下列说法正确的是( )
CH3OH(g)。平衡常数如下表:下列说法正确的是( )
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A. 该反应的△H> 0
B. 加压、增大H2浓度和加入催化剂都能提高CO的转化率
C. 工业上采用5 ×103 kPa和 250℃的条件,其原因是原料气的转化率高
D. t℃时,向 1 L密闭容器中投入0.1 mol CO和0.2 mol H2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com