
����Ŀ��ijͬѧ������������ȡ��������(��Ҫ�ɷ�ΪFe2O3��SiO2��Al2O3����������������)��ȡ��ˮ����������(FeSO4��7H2O)��������������̣�

����˵������ȷ���ǣ� ��
A. �ܽ�����ѡ���������ᣬ�Լ�Xѡ������
B. ����1��һ������SiO2������pH��Ϊ��ʹAl3+ת��ΪAl(OH)3���������2
C. ����Һ2�õ�FeSO4��7H2O��Ʒ�Ĺ����У������������ֹ�������ͷֽ�
D. ���ı䷽��������Һ1��ֱ�Ӽ�NaOH���������õ��ij����������ܽ⣬����Һ���ᾧ����Ҳ�ɵõ�FeSO4��7H2O
���𰸡�D
��������
A�����������ͼ���������Fe2O3��Al2O3��ת��Ϊ�����Σ���ȥSiO2��Ȼ�������ۻ�ԭFe3+�õ�����������A��ȷ��B������1ΪSiO2������FeSO4��Al2(SO4)3���õ��ǵ���pH�ķ�����ʹAl3+ת��ΪAl(OH)3�����Ӷ���FeSO4���룬B����ȷ��C��Fe2+���ױ������������ڵõ�FeSO4��7H2O��Ʒ�Ĺ����У�Ҫ��ֹ�䱻�����ͷֽ⣬C��ȷ��D������Һ1��ֱ�Ӽӹ�����NaOH�õ�����Fe(OH)2��������Fe(OH)2���ȶ��������ױ�����ΪFe(OH)3�������Ļ����������õIJ�Ʒ���������н϶������Fe2(SO4)3��D����ȷ����ѡD��


 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����T�������£���1L�̶�������ܱ�����M�м���2 mol X��1 mol Y���������·�Ӧ�� 2X(g) + Y(g) ![]() a Z(g) + W(g) ��H = ��Q kJ��mol��1 (Q>0)������Ӧ�ﵽƽ���Ӧ�ų�������ΪQ1 kJ������X��ת����Ϊ������ƽ����������¶ȣ���������ƽ����Է���������С����
a Z(g) + W(g) ��H = ��Q kJ��mol��1 (Q>0)������Ӧ�ﵽƽ���Ӧ�ų�������ΪQ1 kJ������X��ת����Ϊ������ƽ����������¶ȣ���������ƽ����Է���������С����
��1����ѧ������a��ֵΪ____________________���˷�Ӧ���淴Ӧ��S__________0 (�,��,��)��
��2������˵������˵���÷�Ӧ�ﵽ�˻�ѧƽ��״̬����___________________________��
A��������ѹǿһ�� B��v(X)��=2 v (Y)��
C��������Z������һ�� D�����������������һ��
E��������������ܶ�һ�� F��X��Y��Z��W��Ũ��֮��Ϊ2��1��a��1
��3��ά���¶Ȳ��䣬����ʼʱ��������м�������ʵ��������и����Ӧ�ﵽƽ���(ϡ�����岻���뷴Ӧ),��֮�ǵ�Чƽ�����______________��
A��2 mol X��1mol Y��1mol Ar B��a mol Z��1mol W
C��1 molX��0.5mol Y��0.5a mol Z��0.5 mol W D��2 mol X��1mol Y��1mol Z
��4��ά���¶Ȳ��䣬����ʼʱ�������м���4mol X��6 mol Y������ƽ��ʱ�����ڵ�ѹǿ��С��15%����Ӧ�зų�������Ϊ___________________kJ��
��5����֪���÷�Ӧ��ƽ�ⳣ�����¶ȵı仯���±���
�¶�/�� | 150 | 200 | 250 | 300 | 350 |
ƽ�ⳣ��K | 9.94 | 5.2 | 1 | 0��5 | 0��21 |
�Իش��������⣺
����ij�¶��£�2 mol X��1 mol Y�ڸ������з�Ӧ��ƽ�⣬ X��ƽ��ת����Ϊ50��������¶�Ϊ__________________�档
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijǿ������ҺX�к���Ba2+��Al3+��NH4+��Fe2+��Fe3+��CO32-��SO32-��S![]() ��Cl-��N
��Cl-��N![]() ���е�һ�ֻ���,ȡ����Һ��������ʵ��,ʵ���������:(��֪����D�ڳ��³�ѹ�³ʺ���ɫ)
���е�һ�ֻ���,ȡ����Һ��������ʵ��,ʵ���������:(��֪����D�ڳ��³�ѹ�³ʺ���ɫ)

��1������������,��ҺX�г�H+��϶������е�������_,һ��������������__������ȷ���Ƿ��е�������_______���������������ӵķ�����________��
��2������G�Ļ�ѧʽΪ______��
��3��д������A�����ӷ���ʽ:________��
��4��д����ҺH��ͨ�����CO2�����ӷ���ʽ:________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڹ輰�仯����������У��������
A. ˮ��������ճ�ϼ����ͻ���� B. ������뵼�����
C. ��ͨ�������ʿ��ʯ��ʯΪԭ�� D. �����������������ά��ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.  �Ľṹ�к�������
�Ľṹ�к�������
B. ˳��2����ϩ�ͷ���2����ϩ�ļ�����ﲻͬ
C. 1mol�����ǿ�ˮ������2 mol���ᣨC3H6O3��
D. ���Ӵ�  �ܷ���������ȡ����ˮ�⣬�Ӿ۷�Ӧ
�ܷ���������ȡ����ˮ�⣬�Ӿ۷�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����������������ȷ����(����)
A.�ǽ���������һ��������������B.����������һ���ǽ���������
C.����������һ���Ƿǽ���������D.���������ﶼ����ˮ�������ɼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. CH4(g)+2O2(g)=CO2(g)+2H2O(g) ��H=-801.3kJ��mol��1�����ۣ�CH4 ��ȼ����Ϊ��H=-801.3kJ��mol��1
B. ϡ��Һ���� H��(aq)+OH��(aq)=H2O(l) ��H=-57.3kJ/mol�����ۣ��������백ˮ��ϡ��Һ��Ϻ������� 1mol H2O�����ų� 57.3kJ ������
C. Sn(s����)![]() Sn(s����) ��H=+2.1kJ/mol (����Ϊ��ĩ״)�����ۣ�����Ʒ�ں���Ķ�������ת��Ϊ��������
Sn(s����) ��H=+2.1kJ/mol (����Ϊ��ĩ״)�����ۣ�����Ʒ�ں���Ķ�������ת��Ϊ��������
D. C(s��ʯī)+O2(g)=CO2(g) ��H=��393.5kJ/mol C(s�����ʯ)+O2(g)=CO2(g) ��H=��395kJ��mol��1�����ۣ���ͬ�����½��ʯ���ʱ�ʯī�ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����״�����
I. (1)��Ȳ�ĵ���ʽ___________��
(2)�߾���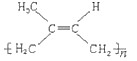 �䵥��Ľṹ��ʽΪ___________��
�䵥��Ľṹ��ʽΪ___________��
(3) 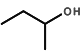 �����ƣ�ϵͳ��������___________��
�����ƣ�ϵͳ��������___________��
(4)![]() ����__________����
����__________����
II. ij�����廯����ķ���ʽΪC7H8O����������ʵ������ȷ����ṹ��ʽ��Ҫ��ÿС��ֻ�����һ���𰸼���)
�ٲ���������Ʒ�Ӧ����ṹ��ʽ__________________��
�������Ʒ�Ӧ������FeCl3����ɫ_________________��
III . (1) �۱�ϩ������һ�ָ���ˮ����֬����ṹ��ʽΪ___________��
(2)д�����и߷��ӻ�����ĵ��壺
��![]() ___________��
___________��
��![]() ___________��
___________��
(3) һ�־�̼�����Ľṹ��ʽΪ��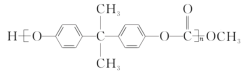 ��������ɫ��ѧԭ��̼�������
��������ɫ��ѧԭ��̼�������![]() �����������������۶��ɵ�___________��
�����������������۶��ɵ�___________��
A����±���� B�������� C����ȩ�� D����ϩ��
��Ӧ����ʽΪ___________���þۺ���Ϊ__________ �߷��ӣ�����͡������͡�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С�����ü״�ȼ�ϵ�ؽ������µ��ʵ�飬���м׳ص��ܷ�ӦʽΪ2CH3OH+3O2+4KOH=2K2CO3+6H2O������˵������ȷ����

A. �׳���ͨ��CH3OH�ĵ缫��Ӧ��CH3OH-6e-+8OH-=CO32-+6H2O
B. �׳�������560mLO2����״���£��������ҳ�Ag�缫����3.2g
C. ��Ӧһ��ʱ������ҳ��м���һ����Cu(OH)2���壬��ʹCuSO4��Һ�ָ���ԭŨ��
D. �����Ҳ�Pt�缫�ĵ缫��Ӧʽ��Mg2++2H2O+2e-=Mg(OH)2��+H2��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com