
【题目】易混易错题组
I. (1)乙炔的电子式___________。
(2)高聚物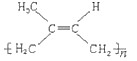 其单体的结构简式为___________。
其单体的结构简式为___________。
(3) 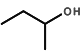 的名称(系统命名法)___________。
的名称(系统命名法)___________。
(4)![]() 属于__________类化合物。
属于__________类化合物。
II. 某芳香族化合物的分子式为C7H8O,根据下列实验现象确定其结构简式(要求:每小题只需给出一个答案即可)
①不能与金属钠反应,其结构简式__________________。
②能与钠反应,但遇FeCl3不显色_________________。
III . (1) 聚丙烯酸钠是一种高吸水性树脂,其结构简式为___________。
(2)写出下列高分子化合物的单体:
①![]() ___________。
___________。
②![]() ___________。
___________。
(3) 一种聚碳酸酯的结构简式为: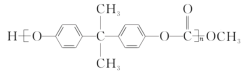 ,可用绿色化学原料碳酸二甲酯
,可用绿色化学原料碳酸二甲酯![]() 与下列那种物质缩聚而成的___________。
与下列那种物质缩聚而成的___________。
A.二卤化物 B.二酚类 C.二醛类 D.二烯类
反应方程式为___________,该聚合物为__________ 高分子(填“体型”或“线型”)。
【答案】 ![]() CH2=C(CH3)CH=CH2 2-丁醇 酯
CH2=C(CH3)CH=CH2 2-丁醇 酯 ![]()
![]()
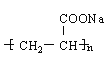 CH2=CH2和CH3CH=CH2 HOOC(CH2)4COOH和HOCH2CH2OH B
CH2=CH2和CH3CH=CH2 HOOC(CH2)4COOH和HOCH2CH2OH B 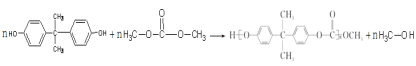 线型
线型
【解析】I.(1)乙炔分子中两个碳原子共用三对电子;(2)去掉括号单键变双键,双键变单键;(3)该有机物属于醇,主链有4个碳原子,羟基在2号碳原子上;(4)官能团为酯基,属于酯类。
II.芳香族化合物C7H8O,可能为醇、酚或醚;
III .(1)CH2=CHCOONa发生加聚反应生成聚丙烯酸钠;
(2)①![]() 为加聚产物。
为加聚产物。
②![]() 为缩聚产物。
为缩聚产物。
聚碳酸酯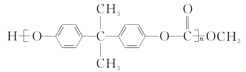 ,发生水解得聚二酚化合物与碳酸二甲酯。
,发生水解得聚二酚化合物与碳酸二甲酯。
I.(1)根据乙炔的结构式写出电子式为:![]() 。
。
(2)高聚物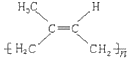 链节4个碳,中间有双键,去掉括号单键变双键,双键变单键,其单体的结构简式为CH2=C(CH3)CH=CH2。
链节4个碳,中间有双键,去掉括号单键变双键,双键变单键,其单体的结构简式为CH2=C(CH3)CH=CH2。
(3) ![]() 官能团为羟基,该有机物属于醇,主链有4个碳原子,羟基在2号碳原子上,故名称为(系统命名法)2-丁醇。
官能团为羟基,该有机物属于醇,主链有4个碳原子,羟基在2号碳原子上,故名称为(系统命名法)2-丁醇。
(4)![]() 属于酯类化合物。
属于酯类化合物。
II.①芳香族化合物C7H8O,不能与金属钠反应,所以不含有羟基,其结构简式为![]() 。
。
②芳香族化合物C7H8O,能与钠反应,但遇FeCl3不显色,所以含有醇羟基,不含有酚羟基,其结构简式为![]() 。
。
III .(1)聚丙烯酸钠结构简式为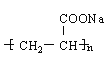
(2)①![]() 加聚产物的单体推断方法:凡链节中主碳链为4个碳原子,无碳碳双键结构,其单体必为两种,从主链中间断开后,再分别将两个半键闭合。因此,该高聚物的单体为CH2=CH2和CH3CH=CH2。
加聚产物的单体推断方法:凡链节中主碳链为4个碳原子,无碳碳双键结构,其单体必为两种,从主链中间断开后,再分别将两个半键闭合。因此,该高聚物的单体为CH2=CH2和CH3CH=CH2。
②![]() 单体为HOOC(CH2)4COOH与HOCH2CH2OH。
单体为HOOC(CH2)4COOH与HOCH2CH2OH。
(3)聚碳酸酯 ,发生水解得聚二酚化合物与碳酸二甲酯。故聚碳酸酯是由碳酸二甲酯(
,发生水解得聚二酚化合物与碳酸二甲酯。故聚碳酸酯是由碳酸二甲酯(![]() )与二酚类
)与二酚类 缩合聚合而成。故选B。
缩合聚合而成。故选B。
生成聚碳酸酯的反应方程式为:
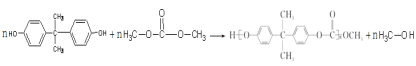 ,
,
该聚合物为线型高分子。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】表中是常温下某些一元弱酸的电离常数:
弱酸 | HF | HNO2 | HCN | CH3COOH |
电离常数 | 6.8×10-4 | 6.4×10-6 | 6.2×10-10 | 1.8×10-6 |
则0.1mol/L的下列溶液中,酸性最强的是( )
A.CH3COOHB.HNO2C.HCND.HF
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质或反应在生活中的应用错误的是
A. 合金具有优良性能,可用于制造新型金属材料
B. 氧化铁俗称铁红,可用作红色油漆和外墙涂料
C. 二氧化硫具有漂白性,常用来漂白食品
D. HF与SiO2的反应可用作在玻璃器皿上刻蚀标记
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验题
I.基本实验:下列实验操作不正确的是________________。
A.用硫酸铜溶液来分离提纯蛋白质
B.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合加热,冷却,加入稀硝酸酸化,再滴加硝酸银溶液
C.醇中含有少量水可加入硫酸铜再蒸馏制得无水乙醇
D.试管中先加入一定量浓硫酸,再依次加入适量冰醋酸、无水乙醇,然后加热制取乙酸乙酯
E.向丙烯醛(CH2=CH—CHO)中滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键
F.配制银氨溶液时,将稀氨水慢慢滴入硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
G.可以用热的浓NaOH溶液来区分植物油和矿物油
H.向经唾液充分作用后的苹果汁中滴入碘化钾检验淀粉的存在
I.将纤维素和稀H2SO4加热水解后的液体取出少许,加入新制的Cu(OH)2悬浊液并加热,有红色沉淀生成,证明水解生成了葡萄糖
II.课本实验:
⑴在一支洁净试管中配制2 mL银氨溶液,加入1 mL 10%葡萄糖溶液,振荡并在水浴中加热,反应的化学方程式是___________。
⑵在一支洁净试管中加入2 mL 10%硫酸铜溶液,滴入2%氢氧化钠溶液4~6滴,配制Cu(OH)2悬浊液,再加入2 mL 10%葡萄糖溶液,加热,没有得到红色沉淀,原因是___________。
⑶少量的盐[如(NH4)2SO4、Na2SO4、NaCl等]能促进蛋白质溶解,但当盐溶液浓度较大时,则会使蛋白质的溶解度降低而从溶液中析出,这种作用称为_______,但加入醋酸铅溶液时,蛋白质会发生____________。
III.实验延伸:(1)下列括号内的物质为杂质,将除去下列各组混合物中杂质所需的试剂及分离方法填写在横线上:
①乙酸乙酯(乙醇)______________________②甲苯(溴)___________。
③甲醛(甲酸)_____________________④硬质酸钠(甘油)___________。
(2) 可将己烯、甲苯、溴苯、水和NaOH溶液区分开来的一种试剂是___________。
(3)如何用化学方法鉴别1-丙醇和2-丙醇___________。
IV. 综合实验:某化学小组采用类似制乙酸乙酯的装置(如下图),以环己醇制备环己烯。

已知:![]()
密度(g·cm-3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品:
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
实验过程中可能发生的有机副反应的方程式为:_______________________________。
(2)制备精品:
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在____(填“上”或“下”)层,分液后用________(填编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从________(填“f”或“g”)口进入。蒸馏时要加入生石灰,目的是_____________________。

③实验制得的环己烯精品质量低于理论产量,可能的原因是______(填字母序号,下同)。
a.蒸馏时从70 ℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象不能说明相应的化学反应一定是放热反应的是
选项 | A | B | C | D |
反应装置 |
|
|
|
|
实验现象 | 试管中生石灰和水混合后,A处红色水柱下降 | 反应开始后,针筒活塞向右移动 | 温度计的水银柱不断上升 | 饱和石灰水变浑浊 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,总反应为2Cu+Ag2O=Cu2O+2Ag。下列有关说法正确的是

A. 正极的电极反应式:Ag2O-2e-+2H2O=2Ag+2OH-
B. 2 mol Cu与1 mol Ag2O的总能量低于1mlCu2O与2 molAg的总能量
C. 电池工作时,OH-向Ag2O /Ag电极移动
D. 水泥固化过程中自由水分子减少,导致溶液中各离子浓度的变化,从而引起电动势变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某非金属单质A经下图所示的过程转化为含氧酸D,
![]()
已知D为强酸,请回答下列问题:
(1)若A常温下为淡黄色固体,B是有刺激性气味的无色气体。
①氯水和B皆可作漂白剂。若同时使用于漂白一种物质时,其漂白效果是________(填“增强”“减弱”“不变” ),用化学方程式解释上述原因_________________;
②D的浓溶液与铜发生反应的化学方程式:________________________________。
(2)若A在常温下为气体,C是红棕色气体。
①A转化为B的化学方程式是:______________________________________,
② D的稀溶液常温下可与铜反应并生成B气体,请写出该反应的离子方程式:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com