
【题目】表中是常温下某些一元弱酸的电离常数:
弱酸 | HF | HNO2 | HCN | CH3COOH |
电离常数 | 6.8×10-4 | 6.4×10-6 | 6.2×10-10 | 1.8×10-6 |
则0.1mol/L的下列溶液中,酸性最强的是( )
A.CH3COOHB.HNO2C.HCND.HF
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在化工生产、污水处理等领域应用广泛。
(1)煤制得的化工原料气中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
i.水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g)△H1
H2S(g)+CO2(g)△H1
ⅱ.氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) △H2
H2S(g)+CO(g) △H2
已知反应中相关的化学键键能数据如下表:
化学键 | H-H | C=O(COS) | C=S | H-S | C |
E/kJ·mol-1 | 436 | 745 | 580 | 339 | 1076 |
①一定条件下,密闭容器中发生反应i,其中COS(g)的平衡转化率(a)与温度(T)的关系如图(a)所示。则A、B、C三点对应的化学反应速率大小顺序为_________(填标号)。

②结合上表中数据,计算反应ⅱ的△H2为___________。
③反应ⅱ的正、逆反应的平衡常数(K)与温度(T)的关系如上图(b)所示,其中表示逆反应的平衡常数(K)的曲线是_______________(填“A”或“B”)。T1℃时,向容积为2L的恒容密闭容器中充入2 mol COS(g)和1molH2(g),发生反应ⅱ,COS的平衡转化率为__________________。
(2)过二硫酸是一种强氧化性酸,其结构式如下所示,
 ,在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,该反应的离子方程式为______。
,在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,该反应的离子方程式为______。
(3)NaHS可用于污水处理的沉淀剂。
已知:25℃时,反应Hg2+(aq)+HS-(aq)![]() HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。则Ksp(HgS)=__________。
HgS(s)+H+(aq)的平衡常数K=1.75×1038,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15。则Ksp(HgS)=__________。
(4)降低SO2的排放量已经写入2018年政府工作报告,某种电化学脱硫法装置如下图所示,不仅可脱除烟气中的SO2,还可以制得H2SO4。在阴极放电的物质是_____________,在阳极生成SO3的电极反应式是__________________。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃条件下,向1L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应: 2X(g) + Y(g) ![]() a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)。当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)化学计量数a的值为____________________;此反应的逆反应△S__________0 (填﹤,﹥,﹦)。
(2)下列说法中能说明该反应达到了化学平衡状态的是___________________________。
A、容器内压强一定 B、v(X)正=2 v (Y)逆
C、容器内Z分子数一定 D、容器内气体的质量一定
E、容器内气体的密度一定 F:X、Y、Z、W的浓度之比为2∶1∶a∶1
(3)维持温度不变,若起始时向该容器中加入的物质的量如下列各项,则反应达到平衡后(稀有气体不参与反应),与之是等效平衡的是______________。
A.2 mol X、1mol Y、1mol Ar B.a mol Z、1mol W
C.1 molX、0.5mol Y、0.5a mol Z、0.5 mol W D.2 mol X、1mol Y、1mol Z
(4)维持温度不变,若起始时向容器中加入4mol X和6 mol Y,若达平衡时容器内的压强减小了15%,则反应中放出的热量为___________________kJ。
(5)已知:该反应的平衡常数随温度的变化如下表:
温度/℃ | 150 | 200 | 250 | 300 | 350 |
平衡常数K | 9.94 | 5.2 | 1 | 0.5 | 0.21 |
试回答下列问题:
若在某温度下,2 mol X和1 mol Y在该容器中反应达平衡, X的平衡转化率为50%,则该温度为__________________℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.活化分子的碰撞就是有效碰撞
B.反应物分子(或离子)间的碰撞是反应的先决条件
C.增大压强,可增大活化分子的百分数,所以反应速率加快
D.增大反应物浓度,可增大活化分子的百分数,所以反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸锰可用于制造钠离子电池的负极材料。可用如下反应制得乙酸锰:4Mn(NO3)2·6H2O+26(CH3CO)2O =4(CH3COO)3Mn +8HNO2+ 3O2↑+40CH3COOH
(1)Mn3+基态核外电子排布式为______。
(2)NO中氮原子轨道的杂化类型是______。
(3)与HNO2互为等电子体的一种阴离子的化学式为______。
(4)配合物[Mn(CH3OH)6]2+中提供孤对电子的原子是______。
(5)CH3COOH能与H2O任意比混溶的原因,除它们都是极性分子外还有______。
(6)镁铝合金经过高温淬火获得一种储钠材料,其晶胞为立方结构(如图所示),图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、S![]() 、Cl-、N
、Cl-、N![]() 。中的一种或几种,取该溶液进行连续实验,实验过程如下:(已知气体D在常温常压下呈红棕色)
。中的一种或几种,取该溶液进行连续实验,实验过程如下:(已知气体D在常温常压下呈红棕色)

(1)上述离子中,溶液X中除H+外肯定还含有的离子是_,一定不含的离子是__,不能确定是否含有的离子是_______,检验其中阳离子的方法是________。
(2)沉淀G的化学式为______。
(3)写出生成A的离子方程式:________。
(4)写出溶液H中通入过量CO2的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于硅及其化合物的叙述中,错误的是
A. 水玻璃可做粘合剂及耐火材料 B. 硅可做半导体材料
C. 普通玻璃以黏士和石灰石为原料 D. 二氧化硅是制作光导纤维的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】易混易错题组
I. (1)乙炔的电子式___________。
(2)高聚物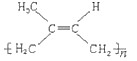 其单体的结构简式为___________。
其单体的结构简式为___________。
(3) 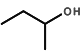 的名称(系统命名法)___________。
的名称(系统命名法)___________。
(4)![]() 属于__________类化合物。
属于__________类化合物。
II. 某芳香族化合物的分子式为C7H8O,根据下列实验现象确定其结构简式(要求:每小题只需给出一个答案即可)
①不能与金属钠反应,其结构简式__________________。
②能与钠反应,但遇FeCl3不显色_________________。
III . (1) 聚丙烯酸钠是一种高吸水性树脂,其结构简式为___________。
(2)写出下列高分子化合物的单体:
①![]() ___________。
___________。
②![]() ___________。
___________。
(3) 一种聚碳酸酯的结构简式为: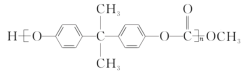 ,可用绿色化学原料碳酸二甲酯
,可用绿色化学原料碳酸二甲酯![]() 与下列那种物质缩聚而成的___________。
与下列那种物质缩聚而成的___________。
A.二卤化物 B.二酚类 C.二醛类 D.二烯类
反应方程式为___________,该聚合物为__________ 高分子(填“体型”或“线型”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com