
【题目】氧化还原反应在日常生活和生产中应用广泛,结合相关知识回答下列问题:
I.根据反应①~③,回答下列问题:
①Cl2+2KI=2KCl+I2 ②2FeCl2+Cl2=2FeCl3 ③2FeCl3+2HI=2FeCl2+2HCl+I2
(1)反应②的反应类型为___(填字母)。
A.置换反应 B.复分解反应 C.分解反应 D.氧化还原反应
(2)对于反应③,氧化产物是___,还原产物是___。
(3)根据上述三个反应可判断出Cl-、I-、Fe2+三种物质的还原性由强到弱顺序为___。
II.实验室可以用 KMnO4固体和浓盐酸反应制取少量Cl2,反应的化学方程式为:__KMnO4+__HCl(浓)-__KCl+__MnCl2+__Cl2↑+__H2O,回答下列问题:
(1)请配平上述化学方程式。___
(2)浓盐酸在反应中表现的性质是___。
(3)该反应中氧化剂和还原剂的物质的量之比为___。
III.饮用水中NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O,请回答下列问题:
(1)上述反应中,被还原的物质是___。
(2)用双线桥标出反应中电子转移的方向和数目。___
(3)上述反应中若标准状况下产生11.2L气体,则转移电子的数目为___。
【答案】D I2 FeCl2 I >Fe2+>Cl 2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O 酸性,还原性 1:5 NaNO3 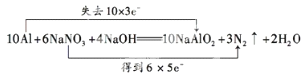 5NA
5NA
【解析】
I.(1)依据反应类型进行归类;
(2)依据氧化还原反应的概念分析;
(3)依据氧化还原反应的规律由强到弱分析;
II.(1)利用电子守恒配平;
(3)依据电子守恒计算。
I.(1) 反应②的反应类型从物质的组成看属于化合反应,从化合价是否发生变化分析是氧化还原反应,故选:D.
(2) 对于反应③,铁元素的化合价降低,所以FeCl2是还原产物,碘元素的化合价升高,所以碘单质是氧化产物,
故答案为:I2;FeCl2.
(3)反应的还原剂是I,还原产物是Cl,依据氧化还原反应由强到弱规律,还原性:I> Cl,同理反应,还原剂是Fe2+,还原产物是Cl,还原性Fe2+> Cl,反应还原剂是I,还原产物是Fe2+,还原性I> Fe2+,故还原性强弱顺序是:I >Fe2+>Cl
故答案为:I >Fe2+>Cl
II.(1)反应中KMnO4→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,Cl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数,配平后的方程式为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,
故答案为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)浓盐酸中氯元素的化合价部分升高,也有一部分没有发生变化,所以作用是酸性,还原性,
故答案为:酸性,还原性
(3)氧化剂是KMnO4,还原剂是HCl,依据电子守恒的得,氧化剂和还原剂的物质的量之比为1:5,
故答案为:1:5
III.(1)氮元素的化合价降低被还原,所以被还原的是NaNO3,
故答案为:NaNO3
(2)铝作还原剂失去电子,硝酸钠作氧化剂得到电子,转移电子数是30,所以双线桥标出反应中电子转移的方向和数目
(3) 标准状况下产生11.2L气体,则转移电子的数目为N=n×NA=V÷Vm×NA×2×5=11.2L÷22.4L/mol×NA×2×5=5 NA,
故答案:5 NA


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述不正确的是
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 与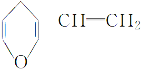 互为同分异构体的芳香化合物有6种
互为同分异构体的芳香化合物有6种
C. 青蒿素 ![]() 的一氯取代物有(不含立体异构)有7种
的一氯取代物有(不含立体异构)有7种
D. 菲的结构简式为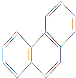 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有m g某气体,它由双原子分子构成,它的摩尔质量为M g/mol.若阿伏加德罗常数的值用NA表示,则:
(1)该气体的物质的量为______mol.
(2)该气体所含原子总数为______个.
(3)该气体在标准状况下的体积为______L.
(4)该气体溶于1L水中(不考虑反应),形成的溶液溶质的质量分数为______.
(5)该气体溶于水形成VL溶液,其溶液的物质的量浓度为______mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫尔盐[(NH4)2Fe(SO4)26H2O,Mr=392]是一种重要的还原剂,在空气中比一般的亚铁盐稳定。某学习小组设计如下实验制备少量的莫尔盐并测定其纯度。
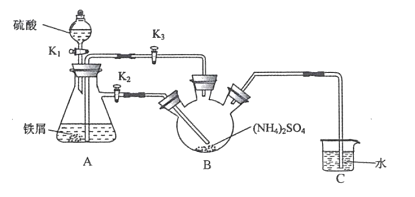
回答下列问题:
Ⅰ制取莫尔盐
(1)连接装置,检査装置气密性。将0.1mol(NH4)2SO4,晶体置于玻璃仪器中______(填仪器名称),将6.0g洁浄铁屑加人锥形瓶中。
(2)①打开分液漏斗瓶塞,关闭活塞K3,打开K2、K1,加完55.0mL2mol·L-1稀硫酸后关闭K1。A装置中反应的离子方程式为____
②待大部分铁粉溶解后,打开K3、关闭K2,此时可以看到的现象为_______,原因是_______
③关闭活塞K2、K3,采用100℃水浴蒸发B中水分,液面产生晶膜时,停止加热,冷却结晶、____、用无水乙醇洗涤晶体。该反应中硫酸需过量,保持溶液的pH在1~2之间,其目的为____
④装置C的作用为 ____,装置C存在的缺点是____
Ⅱ.测定莫尔盐样品的纯度
(3)称取所得莫尔盐样品10.0g,用煮沸后冷却的蒸馏水配成100mL溶液,取20.00mL溶液加人稀硫酸,用0.1molL-1的KMnO4溶液滴定,达到滴定终点时消耗10.00mlKMnO4溶液。滴定反应的离子方程式为____,该样品的纯度为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 因为二氧化硫具有漂白性,所以它能使品红溶液、溴水、高锰酸钾溶液褪色
B. 100mL0.5mol/LH2O2溶液与足量SO2完全反应,转移的电子数为0.1NA
C. 二氧化硫、Cl2以及活性炭都能使红墨水褪色,其原理不同
D. 等物质的量的二氧化硫和氯气相遇在溶液中具有更强的漂白能力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)写出下列物质的化学式:漂白粉的有效成分_______;小苏打________。
(2)写出下列微粒的结构示意图:N________;S2-________。
(3)写出下列物质的电离方程式或者化学方程式:
NH3·H2O的电离方程式________;
镁条在二氧化碳中反应的化学方程式________。
(4)写出分离或提纯下列各组混合物时所需方法的名称:
①分离四氯化碳和水________;
②提取溴水中的溴单质________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生需要用烧碱固体配制0.5mol·L-1的NaOH溶液480mL。实验室提供以下仪器:
①100mL烧杯 ②100mL量筒 ③1000mL容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码) ⑦药匙。请回答下列问题:
(1)计算需要称取NaOH固体_________g。
(2)配制时,必须使用的仪器有_______(填代号),还缺了仪器名称是_________。
(3)配制时,其正确的操作顺序是(字母表示,每个操作只用一次)________。
A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(4)若出现如下情况,其中将引起所配溶液浓度偏高的是___。(填下列编号)
①容量瓶实验前用蒸馏水洗干净,但未烘干 ②定容观察液面时俯视
③配制过程中遗漏了(3)中步骤A ④加蒸馏水时不慎超过了刻度
⑤未等NaOH溶液冷却至室温就转移到容量瓶中
(5)用配制好的溶液,再来配制50ml0.2mol·Lˉ1的NaOH溶液,需要取原配好的溶液_____ml。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧电池的回收处理,既能减少对环境的污染,又能实现资源的再生利用。将废旧锌锰电池初步处理后,所得废料含MnO2、MnOOH、Zn(OH)2及少量Fe等,用该废料制备Zn和MnO2的一种工艺流程如下:
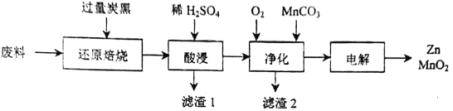
已知:
①Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化
②有关Ksp数据如下表所示
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-13 | 10-17 | 10-38 |
回答下列问题:
(1)还原焙烧过程中, MnOOH与炭黑反应,锰元素被还原为MnO,该反应的化学方程式为___________。传统的工艺是使用浓盐酸在加热条件下直接处理废料,缺点是___________。
(2)酸漫时一般会适当加热并不断搅拌,其作用是___________,滤渣1和滤渣2主要成分的化学式依次是___________。
(3)净化时,先通入O2再加入MnCO3,其目的是___________;已知净化时溶液中Mn2+、Zn2+的浓度约为0.1mol·L-1,调节pH的合理范围是___________。
(4)电解制取MnO2时,MnO2在___________极产生。
(5)中科院研究人员将MnO2和生物质置于一个由滤纸制成的折纸通道内形成电池,该电池可将软饮料中的葡萄糖作为燃料获得能量,装置如图所示。此装置中b极的电极反应式为______________________。
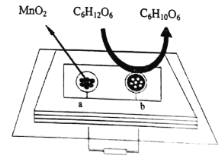
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对![]() 的性质进行探究,设计了以下实验
的性质进行探究,设计了以下实验

已知:![]() 、
、![]() 、
、![]() 等称之为拟卤素,它们的化学性质均与卤素单质相似。下列说法正确的是
等称之为拟卤素,它们的化学性质均与卤素单质相似。下列说法正确的是
A.溶液颜色变红时发生反应的离子方程式是:![]()
B.红色溶液褪色表现了![]() 的漂白性
的漂白性
C.氧化性:![]()
D.无色溶液Ⅱ中滴入适量的![]() 溶液,溶液又变成红色
溶液,溶液又变成红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com