
【题目】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为____________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO________FeO(填“<”或“>”);
(3)NiO晶胞中Ni和O的配位数分别为________、________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示。该合金的化学式为________。
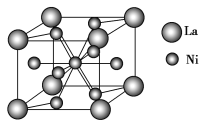
【答案】[Ar]3d84s2或1s22s22p63s23p63d84s2 > 6 6 LaNi5
【解析】
(1)镍是28号元素,根据构造原理写出该原子的核外电子排布式;
(2)离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高;
(3)因为NiO的晶体结构与氯化钠的相同,结合氯化钠中阴阳离子的配位数分析判断;
(4)利用均摊法计算,顶点上的原子算![]() ,面上的原子算
,面上的原子算![]() ,体内的原子算1,由此计算判断化学式。
,体内的原子算1,由此计算判断化学式。
(1)镍是28号元素,Ni的核外电子排布式为1s22s22p63s23p63d84s2,故答案为:1s22s22p63s23p63d84s2;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高,由于Ni2+的离子半径(69 pm)小于Fe2+的离子半径(78pm),因此熔点:NiO>FeO,故答案为:>;
(3)因为NiO的晶体结构与氯化钠的相同,而氯化钠中阴阳离子的配位数均为6,所以NiO晶胞中Ni和O的配位数也均为6,故答案为:6;6;
(4)晶胞中镧原子数8×![]() =1;镍原子数=1+8×
=1;镍原子数=1+8×![]() =5,所以该合金的化学式为:LaNi5,故答案为:LaNi5。
=5,所以该合金的化学式为:LaNi5,故答案为:LaNi5。


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】某盐酸试剂瓶上的标签如图所示。下列有关说法正确的是(设NA表示阿伏加德罗常数的值( )
盐酸
分析纯(AR)
体积:500ml
化学式:HCl
相对分子质量:36.5
质量分数:36.5%
密度:1.19g.ml-1
A.该浓度的盐酸可用广口瓶盛装
B.该盐酸的物质的量浓度为1.19g.ml-1
C.用该盐酸配制250ml2.0mol/L的稀盐酸时需选用100ml的量筒
D.该盐酸中所含Cl-的数目为5.95NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
B.标准状况下,11.2 L CCl4中含有分子的数目为0.5NA
C.2 L 0.5 mol· L-1硫酸钾溶液中阴离子所带电荷数为NA
D.标准状况下,22.4 L氨水含有NA个NH3分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)高聚物I和J在生产、生活中有广泛应用,其合成路线如图:

芳香烃R的分子式为C9H10,其苯环上只有一个取代基,R与H21:1加成后产物的核磁共振氢谱中有5组峰,峰面积之比为1:2:2:1:6。
已知:R'CH=CH2![]() R'CH2CH2Br
R'CH2CH2Br
回答下列问题:
(1)芳香烃R分子的官能团是_________(填官能团符号),R的最简单同系物是_____(填化学名称)。
(2)反应②的化学方程式为__________________。
(3)③和⑦的反应类型分别属于____________、______________________。
(4)高聚物J的结构简式为________________________。
(5)反应⑥的反应条件是______________________。
(6)H与T互为同分异构体,符合下列性质特征的H分子共有________种。
①能发生银镜反应②和氯化铁溶液反应显紫色③能使溴的四氧化碳溶液褪色
(7)仿照上述合成路线,设计一条以R为主要原料制备 的合成路线(无机试剂任选):____________________________________________________。
的合成路线(无机试剂任选):____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
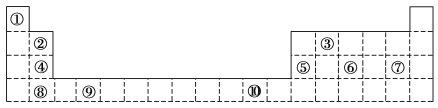
请回答下列问题:
(1)表中属于d区元素的是________(填元素符号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为____;③和⑦形成的一种常见溶剂的化学式为_____。
(3)元素④的第一电离能________元素⑤(选填“>”、“=”或“<”)的第一电离能;元素⑥的电负性________元素⑦(选填“>”、“=”或“<”)的电负性。
(4)元素⑦和⑧形成的化合物的电子式为________________。
(5)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KI是一种重要的食品添加剂,工业上可以通过铁屑法生产,其工艺流程如下:
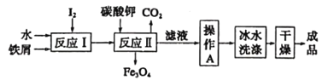
下列说法错误的是
A.若反应Ⅱ是非氧化还原反应,则反应Ⅰ的产物是![]()
B.操作A是蒸发浓缩,冷却结晶,过滤
C.用冰水洗涤的目的是为了缩短产品干燥的时间
D.干燥的装置可以是干燥器
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷及其化合物有重要的用途,回答下列问题:
(1)工业上将磷酸钙、石英砂和碳粉混和在电弧炉中焙烧来制取白磷,配平方程式:
______![]() +______
+______![]() +______
+______![]()
![]() ______
______![]() +______
+______![]() +______
+______![]() 。
。
(2)白磷易自燃,保存的方法是__________________,白磷有毒,皮肤上沾有少量的白磷,可以用硫酸铜溶液处理,发生的反应是:![]() ,该反应的氧化剂是________________________(填化学式)。
,该反应的氧化剂是________________________(填化学式)。
(3)![]() 俗称为膦,电子式为:________________________,沸点比较:
俗称为膦,电子式为:________________________,沸点比较:![]() __________
__________![]() (填”“高于”或“低于”)。
(填”“高于”或“低于”)。
(4)P2O5是常见的气体干燥剂,下列气体能用它干燥的是_______________。
A ![]() B
B![]() C SO2 D CO2
C SO2 D CO2
也可以发生反应:![]() ,该反应中
,该反应中![]() 表现的性质是_________。
表现的性质是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型)。

下列关于普伐他汀的性质描述正确的是 ( )
A. 能与FeCl3溶液发生显色反应
B. 该物质的分子式为C23H38O7
C. 能发生加成、取代、消去反应,能使酸性KMnO4溶液褪色
D. 1mol该物质最多可与1molNaOH反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com