
【题目】NaClO2是一种离效消毒剂、漂白剂在实验室中可用如图装置制备。.
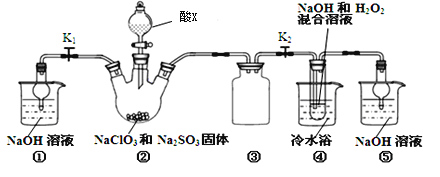
(1)装置②中酸X可以为_____________。
A.盐酸 B.H2SO4 C.HNO3 D.H2C2H4溶液
(2)写出装置②中产生ClO2的离子方程式_____________________。
(3)装置③的作用是_____________,装置④采用冷水欲的原因是__________________。
(4)由装置④反应后的溶液可得到NaClO2晶体,其实验步骤为:
ⅰ.减压,蒸发结晶;ⅱ.___________;ⅲ.热水洗涤;ⅳ.低温干燥,得到成品
(已知低温时NaClO2饱和溶液中会析出NaClO2·3H2O。)
(5)ClO2可用于氧化工厂污水中所含CN-,生成两种无毒无害的气体,写出其离子反应方程式__________。
【答案】 B 2ClO3-+SO32-+2H+═2C1O2↑+SO42-+H2O 安全瓶 防止出H2O2分解 趁热过滤 2ClO2+2CN-═2CO2+N2+2Cl-
【解析】(1)根据亚氯酸钠的氧化性,所选酸不能有强的还原性,且不易挥发,故装置②中酸X可以为硫酸;(2)根据反应物NaClO3、Na2SO3、H2SO4,生成物为ClO2和Na2SO4,配平方程式为2NaClO3 + Na2SO3 + H2SO4=2ClO2 ↑+ 2Na2SO4 + H2O;(3)装置③为安全瓶,防止装置②中气体温度降低而产生倒吸;(4)因为NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,若要得到NaClO2晶体,需在38-60℃得到晶体,故操作为趁热过滤;用38-60℃的温水洗涤;(5)ClO2可用于氧化工厂污水中所含CN-,生成两种无毒无害的气体是二氧化碳和氮气,根据氧化还原反应配平,则其离子反应方程式为:2ClO2+2CN-═2CO2+N2+2Cl-。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 常温常压下,56 g乙烯和丙烯的混合气中含有的碳原子数为4NA
B. 1.2 g NaHSO4晶体中含有的阳离子和阴离子的总数为0.03NA
C. 12 g金刚石中含有的共价键数为4NA
D. 1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是重要的化工原料,但其造成的环境问题也引起了人们的关注。开发寻找SO2的合理替代品是目前化工行业的新动态。
(1)SO2可以与水反应,反应的化学方程式为____________________________________。SO2是大气的主要污染物,是造成__________________的根源。
(2)工业上常用黄铁矿(FeS2)制备SO2,黄铁矿中S的化合价为____________。黄铁矿煅烧后生成1.6gFe2O3,转移的电子数为________。
(3)工业上使用碱液吸收SO2,使排放的尾气达到合格标准:
①将标准状况下11.2LSO2通入到2L0.5mol·L-1的氨水中,所得溶液中溶质是_________(填化学式)。
②常温下,若用1LNaOH若用吸收0.01molSO2,完全吸收后溶液中c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),则原NaOH溶液的pH值为________。
(4)连二亚硫酸钠(Na2S2O4)与SO2相似,具有极强的还原性,可用于保存水果食物。现可用如图所示方法通过吸收SO2和NO,获得Na2S2O4和NH4NO3(Ge为铈元素)

①装置II中,酸性条件下,NO被Ge4+氧化的产物主要是NO3-、NO2-,请写出生成等物质的量的NO3-和NO2-的离子方程式:_______________________________。
②装置III的作用之一是用质子交换膜电解槽电解使得Ge4+再生,同时在另一极生成S2O42-的电极反应式为___________________________。
(5)现今,科学家已研发出比SO2更安全的偏重亚硫酸盐(K2S2O5),工业上常用2KHSO3=K2S2O5+H2O的方法制备。我国要求红酒中添加K2S2O5的标准(按等硫元素质量的SO2计)为0.25g/L。今酿造500吨葡萄酒,需加入K2S2O5的质量为_______。(葡萄酒的密度近似为水,计算结果保留小数点后2位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一份NaOH固体样品,里面混有少量的Na2CO3、NaCl杂质,某同学用中和滴定的方法来测定NaOH的纯度。其操作如下:
①称取a g样品放入锥形瓶中,加水,振荡,使固体充分溶解。
②向该溶液中加入足量的BaCl2溶液,使CO![]() 沉淀完全。
沉淀完全。
③向所得混合液中滴入2~3滴酚酞指示剂,然后用c mol·L-1的盐酸进行滴定。
④当反应达终点时,测得消耗盐酸的体积为V mL。
⑤计算样品的纯度。
试回答下面的问题
(1)滴定终点时溶液颜色如何变化:_____________________________________________。
(2)第②步中生成的BaCO3沉淀未过滤出来就直接用盐酸滴定,是否会对NaoH的含量测定造成影响(填“是”或“否”)___________,理由是_______________________________。
(3)第②步中生成的BaCO3沉淀未过滤出来就直接用盐酸滴定,能否改用甲基橙作指示剂(填“能”或“否”)__________。若改用甲基橙作指示剂则实验结果_______________(填“偏大”、“偏小”或“不变”)。
(4)根据上述实验数据,写出计算NaOH纯度的表达式
__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅及化合物的性质、用途有关叙述中,不正确的是( )
A. 晶体硅是良好的半导体材料B. 硅单质可用来制造太阳能电池
C. 二氧化硅是光导纤维材料D. 常温下二氧化硅不能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用气体传感器可以检测汽车尾气中CO的含量。传感器是以燃料电池为工作原理,其装置如右图所示,该电池中电解质为氧化钇—氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是

A.负极的电极反应式为:CO+O2-![]() 2e-=CO2
2e-=CO2
B.工作时电子由电极a通过传感器流向电极b
C.工作时电极b作正极,O2-由电极a流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数, B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素。E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子。

(1)基态E原子的价电子排布图_______________。
(2)B、C、D三元素第一电离能由大到小的顺序为(用元素符号表示)______________。
(3)BD32-中心原子杂化轨道的类型为________杂化;CA4+的空间构型为__________(用文字描述)。
(4)1mol BC-中含有π键的数目为______NA。
(5)D、E元素最简单氢化物的稳定性 > (填化学式),理由是 。
(6)C、F两元素形成的某化合物的晶胞结构如右图所示,则该化合物的化学式是 ,C原子的配位数是 。若相邻C原子和F原子间的距离为anm,阿伏伽德罗常数为NA,则该晶体的密度为_____________g/cm3(用含a、NA的符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com