
【题目】【化学——选修3:物质结构与性质】已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数, B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素。E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子。

(1)基态E原子的价电子排布图_______________。
(2)B、C、D三元素第一电离能由大到小的顺序为(用元素符号表示)______________。
(3)BD32-中心原子杂化轨道的类型为________杂化;CA4+的空间构型为__________(用文字描述)。
(4)1mol BC-中含有π键的数目为______NA。
(5)D、E元素最简单氢化物的稳定性 > (填化学式),理由是 。
(6)C、F两元素形成的某化合物的晶胞结构如右图所示,则该化合物的化学式是 ,C原子的配位数是 。若相邻C原子和F原子间的距离为anm,阿伏伽德罗常数为NA,则该晶体的密度为_____________g/cm3(用含a、NA的符号表示)。
【答案】(1)![]() (2)N>O>C(3)sp2正四面体(4) 2NA
(2)N>O>C(3)sp2正四面体(4) 2NA
(5)H2O>H2Se H2O中共价键的键能高于H2Se(6)Cu3N 6![]()
【解析】试题分析:A的周期数等于其主族序数A是氢元素;B原子的价电子排布为nsnnpn,n=2,所以B是碳元素;D是地壳中含量最多的元素,D是氧元素;原子序数依次增大,C是氮元素;E是第四周期的p区元素且最外层只有2对成对电子,E是硒元素;F元素的基态原子第四能层只有一个电子,其它能层均已充满电子,F是29号铜元素;
(1)基态Se原子的价电子排布图![]()
(2)N原子2p能级半充满,第一电离能最大,其次是氧原子,C、N、O三元素第一电离能由大到小的顺序为N>O>C。
(3)CO32-中心原子杂化轨道的类型为sp2杂化;NH4+的空间构型为正四面体。
(4)1mol CN-中含有π键的数目为2NA。
(5)O的非金属性大于Se,H2O中共价键的键能高于H2Se,所以稳定性H2O>H2Se
(6)根据均摊原则顶点原子被占用![]() ,N原子数8×
,N原子数8×![]() ,楞上的原子被占用
,楞上的原子被占用![]() ,Cu原子数12×
,Cu原子数12×![]() ,该化合物的化学式是Cu3N,N原子的配位数是6。若相邻N原子和Cu原子间的距离为anm,则晶胞的边长是2anm,晶胞体积为
,该化合物的化学式是Cu3N,N原子的配位数是6。若相邻N原子和Cu原子间的距离为anm,则晶胞的边长是2anm,晶胞体积为![]() cm3,则该晶体的密度为
cm3,则该晶体的密度为![]() =
=![]() 。
。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】NaClO2是一种离效消毒剂、漂白剂在实验室中可用如图装置制备。.
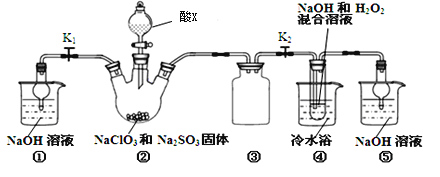
(1)装置②中酸X可以为_____________。
A.盐酸 B.H2SO4 C.HNO3 D.H2C2H4溶液
(2)写出装置②中产生ClO2的离子方程式_____________________。
(3)装置③的作用是_____________,装置④采用冷水欲的原因是__________________。
(4)由装置④反应后的溶液可得到NaClO2晶体,其实验步骤为:
ⅰ.减压,蒸发结晶;ⅱ.___________;ⅲ.热水洗涤;ⅳ.低温干燥,得到成品
(已知低温时NaClO2饱和溶液中会析出NaClO2·3H2O。)
(5)ClO2可用于氧化工厂污水中所含CN-,生成两种无毒无害的气体,写出其离子反应方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.0500 mol·L-1H2C2O4(二元弱酸)溶液滴定 25.00 mL 0.100 0 mol L-1NaOH溶液所得滴定曲线如右图。下列说法正确的是( )

A. 点①所示溶液中:c(H+)+c(H2C2O4)+ c(HC2O4-)=c(OH-)
B. 点②所示溶液中:c(HC2O4-)+c(C2O42-)=c(Na+)
C. 点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D. 滴定过程中可能出现:c(Na+) > c(C2O42-) =c(HC2O4-)>C(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 铁与稀盐酸反应:2Fe+6H+===2Fe3++3H2↑
B. 在过氧化钠中加入稀硫酸:O22- +4H+===2H2O+O2↑
C. 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-===BaSO4↓
D. 澄清石灰水与过量的小苏打溶液反应:Ca2++2OH-+2HCO![]() ===CaCO3↓+2H2O+ CO32-
===CaCO3↓+2H2O+ CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.利用液化石油气中的丙烷脱氢可制取丙烯:C3H8(g)![]() C3H6(g)+H2(g) △H,起始时,向一密闭容器中充入一定量的丙烷,在不同温度、压强下测得平衡时反应体系中丙烷与丙烯的物质的量分数如图所示(已知p1为0.1MPa)。
C3H6(g)+H2(g) △H,起始时,向一密闭容器中充入一定量的丙烷,在不同温度、压强下测得平衡时反应体系中丙烷与丙烯的物质的量分数如图所示(已知p1为0.1MPa)。

(1)反应的△H_____0(填“>”“<”“=”下同)压强P2______0.1MPa
(2)图中A点丙烷的转化率为________。
(3)若图中A、B两点对应的平衡常数用K(A)、K(B)表示,则K(A)______K(B) (填“>”“<”或“=”)。
II.为摆脱对石油的过渡依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示。一个电极通入氧气,另一个电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO3晶体,它在高温填能传导O2-。

(1)以辛烷(C8H18)代替汽油.写出该电池工作时的负极反应方程式:______。
(2)己知一个电子的电量是1.602×10-19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH______g。
Ⅲ.煤燃烧产生的CO2是造成温室效应的主要气体之一。我们常用原子利用率来衡量化学反应过程的原子经济性,其计算公式为原子利用率=(预期产物的总质量/全部反应物的总质量)×100%,将CO2转化成有机物可有效地实现碳循环,如:
a.6CO2+6H2O![]() C6H12O6+6O2
C6H12O6+6O2
b.2CO2 + 6H2![]() C2H5OH +3H2O
C2H5OH +3H2O
c.CO2 + CH4![]() CH3COOH
CH3COOH
d.2CO2 + 6H2![]() CH2=CH2 + 4H2O
CH2=CH2 + 4H2O
以上反应中,最节能的是_______,反应d中理论上原子利用率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的合成对国家工业发展有着举足轻重的作用,请根据化学原理知识回答下列问题:
(1)已知氢气的燃烧热为285.8kJ/mol。
4NH3 (g) +5O2 (g) ![]() 4NO(g) + 6H2O(l) △H= —1168.8kJ/mol
4NO(g) + 6H2O(l) △H= —1168.8kJ/mol
N2(g)+ O2(g)═ 2NO(g)△H = +180.6kJ/mol。
则工业合成氨的热化学方程式为________________。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g) 2NH3(g)反应的影响。实验结果如图所示:(图中 T表示温度, n表示物质的量)

①图像中 T2和 T1的关系是: T2 _______________ T1(填“高于”、“低于”、 “等于”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,反应物N 2 的转化率最高的是_______________(填字母)。
③在起始体系中n(N2):n(H2)= 1:3时,反应后氨的百分含量最大;若容器容积为1L, n=3mol反应达到平衡时H2的转化率为60%,则此条件下( T 2),反应的平衡常数 K=__________________。
(3)氮元素的+4价氧化物有两种,它们之间发生反应:2NO2![]() N2O4 H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化 (气体颜色越深,透光率越小)。下列说法正确的是______________
N2O4 H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化 (气体颜色越深,透光率越小)。下列说法正确的是______________

A.b点的操作是压缩注射器
B.c点与a点相比, c(NO2)增大, c(N2O4)减小
C.若不忽略体系温度变化,且没有能量损失,则b、c两点的平衡常数Kb>Kc
D.d点:v(正)> v(逆)
(4)利用反应6NO2+8NH3=7N2+12H2O构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示。

①电极a为___________________极,其电极反应式为__________________。
②当有0.1 mol NO2被处理时,转移电子为________________mol。
③为使电池持续放电,该离子交换膜需选用___________________交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。

发生的反应如下:
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,并说明理由 。
(2)加入沸石的作用是 。若加热后发现未加沸石,应采取的正确方法 是 。
(3)上述装置图中,B的名称是 ,D仪器的名称是 。
(4)B仪器使用前必须进行的操作是 。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分液时,正丁醛在 层(填“上”或“下”)
(6)反应温度应保持在90—95℃,其原因是 ,为更好的控制温度,可以采取的改进措施是 。
(7)本实验中,正丁醛的产率为 %。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,反应过程如图,下列说法正确的是
2NH3(g) ΔH<0,反应过程如图,下列说法正确的是

A.t1 min时正、逆反应速率相等
B.X曲线表示NH3的物质的量随时间变化的关系
C.0~8 min,H2的平均反应速率v(H2)=0.01 mol·L-1·min-1
D.10~12 min,升高温度使反应速率加快,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列4种重要的有机物:
![]()
![]()
![]()
![]()
请回答:
(1)能与银氨溶液反应生成乙酸铵的是______(填序号)。
(2)能发生加聚反应生成导电高分子材料的是______(填序号)。
(3)写出③与NaOH的乙醇溶液共热生成1,3-丁二烯的化学方程式_______________。
(4)写出④与甲醛反应制取酚醛树脂的化学方程式_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com